2. 青海大学附属医院肿瘤科
胃癌的发生是一个多阶段、多步骤逐渐演进的过程,这一过程中涉及多种癌基因的激活及抑癌基因的失活。北京市肿瘤防治研究所通过cDNA基因芯片表达谱〔1〕分析发现,锌指转录因子2(Snai2)mRNA在不同分化胃癌组织中呈差异表达。为了探讨Snai2mRNA在癌旁组织中分子水平的变化及意义,本实验在前期研究〔2〕基础上,选取2004年5月-9月青海大学附属医院胃癌患者胃癌和癌旁配对组织标本,采用实时荧光定量PCR方法,检测比较锌指转录因子2mRNA的表达水平及变化。结果报告如下。
1 对象与方法 1.1 对象新鲜胃癌和癌旁配对组织30例,其中低分化14例,中分化6例(青海大学附属医院胃癌患者手术切除标本),均由本院病理医师确诊;高分化10例(本院标本库)由北京市肿瘤医院诊断;配对癌旁组织均来自同一病例距癌灶边缘5cm处。所有患者术前均未接受化疗、放疗或其他针对肿瘤的治疗。
1.2 方法 1.2.1 RNA提取及cDNA合成RNA提取试剂(TRIzol)法抽提总RNA,经琼脂糖凝胶电泳鉴定,紫外分光光度仪检测质量和浓度,计算RNA含量,并将提取的RNA按逆转录试剂盒说明合成cDNA第1链。引物设计时将扩增片断放在不同的外显子上,以避免基因组DNA的污染所造成的假阳性。Snai2引物序列如下:上游引物:5' GAC ACA TTA GAA CTC ACA CGG 3';下游引物:5'TAC ACA GCA GCC AGA TTC CT 3',扩增片段为194bp;内参照为β-actin,上游引物:5'GCA CCC AGC ACA ATG AAG 3',下游引物:5'GCC AAT CTC ATC TTG TTT TC 3'。引物由北京奥科生物有限公司合成。
1.2.2 实时荧光定量PCRSnai2和β-actin的PCR产物经琼脂糖凝胶电泳,割胶回收纯化,制成标准品,用三羟甲基氨基甲烷-乙二胺四乙酸(TE)缓冲液1:10稀释成1.0×103,1.0×104,1.0×105,1.0×106,1.0×107,1.0×108(拷贝数/μL)浓度模板,制作标准曲线。2种不同稀释度的标准模板及待测样品以绿色荧光核酸染料(EvaGreen)作为荧光染料,按以下条件进行检测。反应体系:于PCR管中加入10×Buffer2.5μL,dNTP(2.5mmol/L),上游引物和下游引物各1μL,TaqDNA聚合酶0.5μL,DNA模板1μL,荧光染料1.25μL,ddH2O 25μL。反应条件:95.0℃预变性3min;94℃变性45s,56℃退火45s,72℃延伸30s,83℃10s循环40次;然后95.0℃1min,55.0℃1min,以0.5℃/s的速度升温到95℃,连续监测荧光强度值,进行熔解曲线分析;并且每个样品做2个平行管取平均值以减少误差。琼脂糖凝胶电泳对扩增产物进行特异性分析,以所测Snai2与β-actin浓度的比值来反映Snai2表达量。
1.3 统计分析采用SSPS 12.0软件进行分析,由于不同病例的Snai2mRNA表达离散程度大,故采用Wilcoxon秩和检验和Kruskal-WallisH检验进行显著性检验,以P < 0.05为差异有统计学意义。
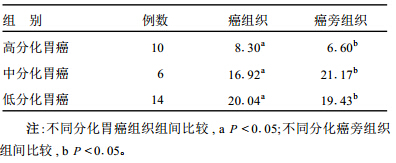
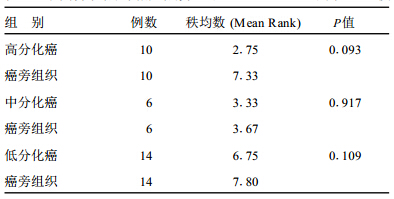
2 结 果 2.1 癌与癌旁组织Snai2 mRNA的表达比较 (表 1)| 表 1 不同分化癌及癌旁组织Snai2mRNA表达的秩和均数 (MeanRank)比较 |
由表 1可知,在不同分化胃癌组织中Snai2mRNA随分化程度的减低,表达量明显增加(P < 0.05);在不同分化的癌旁组织中,中低分化的表达量也明显高于高分化(P < 0.05)。
2.2 Snai2mRNA在不同分化癌与相应癌旁组织的表达 (表 2)| 表 2 不同分化癌与相应癌旁组织Snai2mRNA的表达比较 |
表 2结果表明,不同分化胃癌和相应癌旁组织Snai2mRNA的表达差异无统计学意义。
3 讨 论肿瘤浸润转移的过程其分子机制涉及众多相关基因的改变,其中Snai2也是研究较多的与肿瘤密切相关的基因之一。研究表明,Snai2高表达的肺腺癌细胞易发生浸润和转移〔3〕,导致肿瘤细胞的多药耐受和耐放射治疗〔4, 5〕。在胃癌细胞系,中、低分化,较强致瘤性的Snai2mRNA表达高于分化高,但弱致瘤性的细胞系〔6〕。本研究显示,胃癌组织中Snai2mRNA的表达与肿瘤的分化程度密切相关,而肿瘤的分化程度是衡量肿瘤恶性程度与判断预后重要的指标,在胃肠道间质瘤中Snai2的阳性表达病例预后较差〔7〕,所以,Snai2的高表达意味着肿瘤的转移可能发生较早,放疗,化疗效果差,预后较差;不同分化胃癌与相应癌远旁组织中Snai2mRNA的表达差异无统计学意义,表明传统意义上的癌旁组织中Snai2的表达已有异常。
(致谢:北京大学临床肿瘤学院肿瘤防治研究所分子生物学实验室吕有勇教授,郭瑞芳和藏师竹博士的支持帮助)。
| 〔1〕 | Zang S,Guo R,Zhang L,et a.lIntegration of statistical inference methods and a novel control measure to improve sensitivity and specificity of data analysis in expression profiling studies[J].J Biomed Inform,2007,40(5):552-560. |
| 〔2〕 | 贺菊香,李菊英,赵久达,等.荧光定量PCR验证胃癌基因芯片中Snai2的表达及意义[J].中国现代医学杂志,2009,19(15):2286-2288. |
| 〔3〕 | Shih JY,TsaiMF,Chang TH,et al.Transcription repressor slug promotes carcinoma invasion and p redicts outcome of patients with lung adenocarcinoma[J].Clin Cancer Res,2005,11(22):8070-8078. |
| 〔4〕 | Wu WS,Heinrichs S,Xu D,et al.Slug antagonizes p532mediated apoptosis of hematopoietic progenitors by repressing puma[J].Cell,2005,123(4):641-653. |
| 〔5〕 | Catalano A,Rodilossi S,RippoMR,et a.lInduction of stem cell factor/c-Kit/slug signal transduction in multidrug-resistant malignant mesothelioma cells[J].J Biol Chem,2004,279(45):46706-46714. |
| 〔6〕 | 贺菊香,赵久达,李文梅,等.Snai2在人胃癌细胞系中的差异表达及生物学意义[J].临床与实验病理学杂志,2008,24(6):706-708. |
| 〔7〕 | 贺菊香,梁玉梅,耿排力.胃肠道间质瘤中SNA I2的差异表达与预后关系[J].中国公共卫生,2007,23(5):604-605. |
 2010, Vol. 26
2010, Vol. 26