2. 青岛大学医学院
随着人们生活习惯和饮食结构的改变,糖尿病发病率快速上升,而且发病年龄明显提前。高脂高糖饮食是诱导机体胰岛素抵抗和糖尿病的主要危险因素之一〔1〕。研究发现,胰岛素抵抗和糖尿病的发生发展与体内氧化与抗氧化水平失衡和镁缺乏密切相关〔2, 3〕,补充维生素E (V E)和镁可以改善胰岛素抵抗和糖尿病的异常状态〔4, 5〕。本研究以高能量饮食及链脲咗菌素(STZ)诱导的糖尿病大鼠为模型,观察联合补充 VE和镁对糖尿病大鼠抗氧化和胰岛素抵抗水平的影响,为指导V E和镁的合理应用提供科学依据。
1 材料与方法 1.1 试剂与仪器VE(青岛双鲸公司);谷胱甘肽过氧化物酶(GSH2Px)、超氧化物歧化酶(SOD)检测试剂盒(武汉博士德公司)。稳步便携式血糖仪(美国强生公司);RF 540型荧光分光光度计(日本岛津公司);低温离心机(美国Sigma公司)。
1.2 实验动物清洁级Wistar大鼠88只(山东大学实验动物中心),雌雄各半,体重200~220 g。饲养于(22 ±1)℃动物房中,喂食高能量饲料(含10%猪油,2.5%胆固醇,20%糖和1%胆盐),实验前大鼠适应性喂养1周。
1.3 分组与处理根据空腹血糖,将大鼠随机分为6组,对照组(14只),VE组(15只)饲料中添加0.5 g/kg VE,中(15只)、高(14只)剂量镁组饲料中分别含有镁0.6,1.2 g/kg,VE +中、高剂量镁组(各15只)饲料中分别含VE 0.5+镁0.6,1.2 g/kg。连续喂饲4周后,腹腔注射STZ 40 mg/kg诱导糖尿病模型〔6〕。注射1周后,检测血糖,空腹血糖> 11.1 mmol/ L的大鼠进入后续实验,继续喂养4周。处死大鼠,腹主动脉采血,分离肝脏备用。
1.4 检测方法(3)胰岛素抵抗指数(IR):IR=空腹血糖×空腹胰岛素/22.5。(1) GSH2Px、SOD测定采用试剂盒法。 (2)红细胞溶血度检测〔7〕:溶血度(%)=[A管吸光(A)值/B管吸光(A)值]×100。
1.5 统计分析采用SPSS 10.0软件进行分析。两两比较用Student t检验。
2 结 果 2.1 大鼠一般情况实验过程中有10只大鼠死亡,均出现在注射STZ后2周内,其中对照组3只,VE组1只,中剂量镁组2只,高剂量镁组3只,VE+中剂量镁组1只。死亡大鼠体重、饮食和外观与存活大鼠无明显区别。
2.2 胰岛素抵抗水平变化VE组,中、高剂量镁组,VE+中、高剂量镁组胰岛素抵抗指数分别为(11.85 ±1.47),(15.09 ±1.8),(18.83 ±1.6),(14.08 ±0.93)和(14.72 ± 0.78),与对照组(17.37 ±1.09)比较,VE、VE+中、高剂量镁组胰岛素抵抗指数明显降低(P < 0.05)。以单纯补充VE效果最为明显。
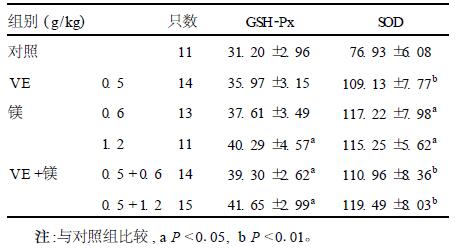
2.3 GSH2Px和SOD活性变化(表 1)| 表 1 不同组别大鼠肝脏GSH2Px和SOD 活性[x±s,μ/ (mg·prot) ] |
与对照组比较,高剂量镁组、VE+中、高剂量镁组GSH2Px活性明显升高(P <0.01)。单独或联合补充VE和镁可以明显提高肝脏SOD活性(P <0.05),以VE+高剂量镁组提高最为明显。
2.4 糖尿病大鼠红细胞溶血度变化VE组,中、高剂量镁组,VE+中、高剂量镁组红细胞溶血度分别为(0.09 ± 0.02)%,(0.06 ±0.01)%,(0.11 ±0.02)%,(0.03 ± 0.00)%和(0.03 ±0.00)%。与对照组(0128 ±0.03)%比较,VE、VE+中、高剂量镁组红细胞溶血度明显降低(P <0.05)。以VE联合镁组效果最佳(P < 0101)。
3 讨 论研究表明,糖尿病患者自由基含量明显高于健康群体,总氧自由基清除能力、SOD、GSH2Px活性明显降低〔8, 9〕。补充VE可以提高机体抗氧化能力,清除自由基,改善胰岛素抵抗状态〔10〕。镁在维持糖代谢平衡和胰岛素活性方面作用明显。研究表明,血浆镁水平与胰岛素敏感性呈负相关〔11〕,镁缺乏可以破坏胰岛素受体酪氨酸激酶活性并提高细胞内钙离子浓度,引起胰岛素抵抗。补充镁可提高糖尿病病人胰岛素敏感性〔12〕。
本研究结果表明,联合补充VE和镁在降低胰岛素抵抗水平、增加GSH2Px和SOD的活性方面优于单独补充VE或镁,在降低红细胞溶血度方面效果更为明显。表明VE和镁的联合应用可以提高抗氧化物酶活性,保护细胞免受脂质过氧化损伤,降低膜渗透性。
| 〔1〕 | 潘海燕, 丁元林, 胡利人, 等.2型糖尿病不同发展阶段影响因素分析[J].中国公共卫生, 2009, 25(6):767-768. |
| 〔2〕 | Volpe SL.Magnesium, the metabolic syndrome, insulin resistance, and type 2 diabetes mellitus[J].Crit Rev Food Sci Nutr, 2008, 48:293-300. |
| 〔3〕 | Evans JL, MadduxBA, Goldfine ID.The molecular basis for oxidative stressinduced insulin resistance[J].Antioxtd Redox Signal, 2005, 7:1040-1052. |
| 〔4〕 | Rodriguez MM, Guerrero RF.Oral magnesium supplementation improves insulin sensitivity and metabolic control in type 2 diabetic subjects:a randomized, doubleblind controlled trial[J].Diabetes Care, 2003, 26:1147-1152. |
| 〔5〕 | Costacou T, Ma B, King IB, et al.Plasma and dietary vitamm E in relation to insulin secretion and sensitivity[J].Diabetes Obes Metab, 2008, 10:223-228. |
| 〔6〕 | 王洪莹.2型糖尿病动物模型的建立[D].长春:吉林大学, 2007. |
| 〔7〕 | 罗勇兵, 杜珍, 马爱国, 等.补充β-胡萝卜素对青年人群红细胞溶血度及淋巴细胞增殖活性影响的研究[J].营养学报, 2007, 29(2):110-112. |
| 〔8〕 | Martin GP, Carrascosa A, Gussinye M, et al.Estimation of lipoperoxidative damage and antioxidant status in diabetic children:relationship with individual antioxidants[J].Ftee Radic Res, 2005, 39:933-942. |
| 〔9〕 | 贾文波, 许继取, 宋方方, 等.2型糖尿病患者胰岛素抵抗和氧化应激反应[J].中国公共卫生, 2006, 22(7):769-771. |
| 〔10〕 | ShirpoorA, AnsariMH, Salami S, et al. Effect of vitamin E on oxidative stress status in small intestine of diabetic rat[J].World J Gastroenterol, 2007, 13:4340-4344. |
| 〔11〕 | Rosolova H, Mayer O, Reaven GM.Insulin2mediated glucose disposal is decreased in normal subjects with relatively low plasma magnesium concentrations[J].Metabolism, 2000, 49:418-420. |
 2010, Vol. 26
2010, Vol. 26