2. 广州市第八人民医院;
3. 广州市疾病 预防控制中心
登革病毒(dengue virus,D EN)为黄病毒科黄病毒属成员〔1, 2〕,含1~4个血清型(D EN-1,D EN-2,D EN-3,和 D EN-4),可引起登革热和登革出血热。登革热广泛流行于热带和亚热带地区〔3〕,在中国流行于广东、海南、广西、云南省和台湾等地。目前尚无有效和安全的疫苗预防,原因之一是尚未建立合适的动物模型。本研究用正常免疫功能的 C57BL/6 j小鼠建立登革病毒感染的动物模型,应用PCR方法测定C57BL/6 j小鼠感染D EN-2后外周血液中病毒含量的变化。
1 材料与方法 1.1 材料登革病毒2型国际标准(NGC)株(本实验室保存);质粒pMD19-T、Taq酶、病毒RNA提取试剂盒和real-time RT2PCR试剂盒(日本TaKaRa公司);DEN-2特异性引物参照文献〔1〕设计;引物序列(+)5′gttcctctgcaaacactcca 3′,(-)5′gtgttattttgagtttccttg3′由上海英俊公司合成。总RNA提取试剂(Trizal)(美国Invitrogen公司);DL-600 DNA Marker、DL -5000 DNA Marker、限制性内切酶B am HⅠ和质粒提取试剂盒(美国CH IMERx公司);凝胶回收试剂盒(东盛公司);Real2 time PCR仪(美国Stratagene公司);1~3 d龄昆明乳鼠,10~ 12周C57BL/6j小鼠(南方医科大学实验动物中心)。
1.2 方法 1.2.1 病毒培养颅内接种DEN-2 NGC于1~3 d龄昆明乳鼠,濒临死亡前无菌取鼠脑组织,冻存于-70℃备用。
1.2.2 病毒RNA的制备脑组织匀浆液250μL,反复冻融 2次,4℃ 12 000 r/min离心10 min,取上清。按病毒RNA提取试剂盒说明书提取病毒RNA。
1.2.3 反转录合成cDNA病毒RNA反转录成cDNA,10μL反应体系如下:2μL 5 ×Buffer,0.5μL RT EnzymeMix Ⅰ,0.5 μL Oligo DT Primer,0.5μL Random 6 mers,总RNA 2μL反应条件:37℃ 15 min,85℃ 5 s,4℃ 5 min,反应完毕将cDNA产物保存于-20℃。
1.2.4 标准品质粒的构建用上述合成引物,PCR法扩增 DEN-2 E蛋白区230 bp片段。反应条件:95℃ 10 min,94 ℃ 1 min,55℃ 1 min,72℃ 45 s,扩增35个循环;最后72℃延伸10 min。PCR产物用115%琼脂糖凝胶电泳分离后,经回收,纯化,连接于pMD19-T载体上。并采用化学法将质粒转化大肠埃希菌DH5α,以氨苄青霉素筛选转化子,经PCR、单酶切鉴定获得阳性克隆。
1.2.5 标准曲线的构建以10倍梯度稀释质粒,共7个稀释浓度,Real-time PCR SYBR法扩增质粒目的片段,反应条件:预变性95℃ 10 s;然后94℃ 60 s,72℃ 15 s,40个循环。
1.2.6 PCR检测成年C57BL/6 j小鼠外周血病毒含量10~ 12周C57BL/6 j小鼠共18只,分成3组,每组6只。第1组腹腔感染DEN-2 NCG株2 ×109 cop ies/只100μL,第2组腹腔感染DEN-2 NGC株2 ×108 cop ies/只100μL,阴性对照组腹腔注射PBS 100μL;分别于感染后的第1,3,5,7 d鼠尾采血 200μL,Trizol法提取全血RNA,将RNA逆转录为cDNA,Re-al-time PCR测定病毒含量。反应条件同前。
2 结 果 2.1 PCR扩增(图 1)经琼脂糖凝胶电泳,获得大小为230 bp目的片段。
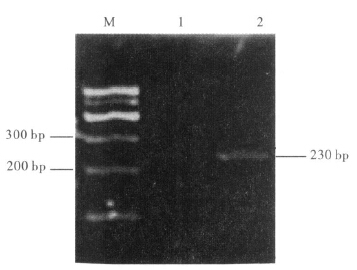 | 注:M: DL600; 1:阴性对照; 2: PCR产物。 图 1 目的片段琼脂凝胶电泳图 |
采用PCR方法对菌液和质粒进行扩增,同时单酶切对重组质粒进行鉴定。
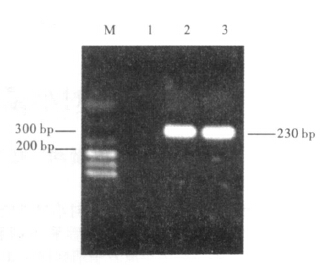 | 注:M: DL600; 1:DH5α菌PCR产物; 2: 重组菌液PCR产物;质粒PCR产物。 图 2 PCR鉴定目的片段 |
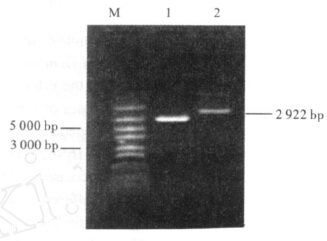 | 注:M: DL600; 1:酶切后重组质粒; 2: 重组质粒。 图 3 质粒单酶切点泳图 |
| 表 1 DEN - 2 NGC株感染C57BL /6 j小鼠血中病毒含量 |
成功的登革热动物模型与多因素有关,包括动物的年龄、遗传背景和机体的免疫力等〔4〕。以前的研究中,多选用4~8周龄的小鼠模型,另有使用登革病毒2型全长cDNA感染性转录体建立动物模型,这仅能满足登革病毒致病机制的研究〔5, 6〕,在登革疫苗的保护性研究中,需测定病毒攻击小鼠后的病毒含量,且不同年龄的小鼠其免疫力不同,故此本研究采用10~12周成年C57BL/6 j小鼠建立动物模型,该鼠为免疫功能健全的近交系小鼠,是疫苗学和免疫病理学中常用的实验动物。小鼠经腹腔感染DEN-2 NGC株,研究登革病毒在 C57BL/6 j小鼠外周血的动力学情况。本研究以DEN-2E蛋白区的大小为230 bp的基因序列为检测目的片段,由构建标准品质粒开始,制作标准曲线,绝对定量PCR的方法测定小鼠感染登革病毒后不同时间血液中病毒含量。从实验结果来看,2 ×108 cop ies/只和2 ×109 cop ies/只2种浓度病毒感染 C57BL/6 j小鼠后,均于第3 d病毒血症达高峰,在2 ×109 cop- ies/只组中更为明显,至第5 d病毒含量开始下降,第7 d几乎消失。这可能是因为C57BL/6 j小鼠为非自然宿主,且免疫功能健全,病毒可被中和。但病毒感染量不同,小鼠体内的中和效果亦不同〔7〕。
本研究以腹腔感染为感染途径,操作易行,对实验者技术要求不高。C57BL/6 j腹腔感染DEN-2 NGC后,虽不产生与人相似的症状,但可模拟相似的病毒血症,用荧光定量PCR的方法测定小鼠血液中病毒含量,可为登革疫苗的保护性试验提供实验数据,以利于体内实验的验证。
| 〔1〕 | 杨佩英,秦鄂德.登革热和登革出血热[M].北京:人民军医出版社,1999:247-253. |
| 〔2〕 | 贡树基,赵卫,曹虹,等.登革2型病毒全长基因组的长链RT2PCR法扩增[J].中国公共卫生,2006,22(4):429-430. |
| 〔3〕 | Guzmanmaria G,Gusravo K.Dengue:an update[J].Infectious Diseases,2002,2:33-42. |
| 〔4〕 | 李玉静,赵卫,张文炳,等.登革病毒不同途径感染Balb/C小鼠的比较[J].广东医学,2008,29(12):1948-1950. |
| 〔5〕 | 李永念,左丽,尚正玲,等.登革2型病毒感染小鼠体内病毒迁移及分布[J].中国公共卫生,2004,20(9):1037-1038. |
| 〔6〕 | Gong S,ZhaoW,ZhangW,et al.Construction of infection RNA transcrip ts from fulllength cDNA of dengue 2 virus[J].M icrobiology,2009,36(5):722-727. |
| 〔7〕 | Stenphenson J.Understanding dengue pathogenesis:implications for vaccine design〔R〕.Bullerin of the World Health O rganization,2005,83:308-314. |
 2010, Vol. 26
2010, Vol. 26

 , 张文炳1, 彭亮1, 郝小燕1, 张复春2, 严子锵3
, 张文炳1, 彭亮1, 郝小燕1, 张复春2, 严子锵3 