2. 温州医学院病理解剖学教研室
肥胖及其相关疾病已成为全世界面临的严重公共健康问题。研究表明,经过重复性饥饿/再投喂方式处理,能激活大鼠体内瘦素(leptin)调节能量平衡以控制体重这一调节系统〔1〕。其下游分子的表达模式是否也会受到重复性饥饿/再投喂的影响,有待进一步研究。ne sfatin-1是在大鼠下丘脑新发现的一个能控制食欲和脂肪蓄积的内源性蛋白分子〔2〕,能编码核酸结合蛋白2(N uc leo bindin 2,NUCB 2)。本研究探讨经过重复性饥饿/再投喂处理大鼠摄取高脂食物后血清leptin及下丘脑NUCB 2的表达变化,旨在探讨肥胖发生的可能机制,为有效治疗肥胖提供新的理论依据。
1 材料与方法 1.1 实验动物清洁级健康雄性SD大鼠72只(温州医学院实验动物中心),体重约200 g。
1.2 试剂与仪器瘦素(leptin)放射免疫试剂盒(北京北方生物技术研究所);兔抗大鼠NUCB 2抗体(美国Santa Cruz公司);二步法免疫组化检测试剂盒(北京中杉金桥生物技术有限公司)。7600型全自动生化分析仪(日本日立公司);SN-695 B型智能放免γ测量仪(上海核所日环光电仪器有限公司)。
1.3 动物分组与处理大鼠适应性饲养1周后,按体重随机分为5组:饥饿组与对照组各12只,分别对其进行重复性饥饿1 d/再投喂1 d (隔天喂以基础饲料)和每天喂以基础饲料的饲喂处理,持续6周;饥饿高脂组与高脂对照组各18只,分别隔天和每天喂以基础饲料6周后,改为每天喂以高脂饲料 (10%猪油、2%胆固醇和88%基础饲料),继续6周;基础对照组12只,持续喂以基础饲料12周。实验末,饥饿高脂组与高脂对照组分别剔除体重增加位于后6位(肥胖抵抗)大鼠各6只,其余动物禁食12 h,腹主动脉采血,分离血清,-20 ℃保存待测。分离下丘脑,取肝中叶小块肝组织,置4%多聚甲醛固定,用于免疫组织化学和病理形态学检测。同时分离睾周和肾周脂肪组织并准确称重。
1.4 检测指标及方法1.4.1 Lee's指数和脂体比测定
称量大鼠体重,测量体长 (从鼻尖至肛门的长度),按照公式计算Lee's指数(动物肥胖评价指数)。Lee's指数=〔体重(g)〕1/3×1 000/体长 (cm);并测定脂肪组织重量,脂体比=脂肪重量(g)/体重 (g)×100。
1.4.2血液相关指标测定生化分析仪检测血清总胆固醇 (TC)、甘油三酯(TG)、高密度脂蛋白(HDL)和低密度脂蛋白 (LDL)含量。血清leptin水平测定采用放射免疫法。按照试剂盒说明书操作。
1.4.3 下丘脑NUCB 2表达采用二步法,操作步骤按照试剂盒说明书。每只大鼠随机选取相同位置的1张下丘脑切片,每张切片随机选择5个高倍镜视野(400×),采用Im age -Pro P lus 6. 0图像分析软件测定阳性染色面积(AREA)和积分吸光度(IA)值,代表蛋白表达水平。
1.5 统计分析采用SPSS 11.5统计软件进行分析,2组间比较采用t检验,多组间比较采用方差分析。
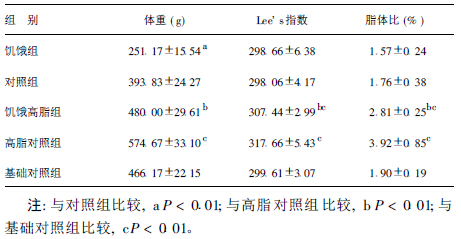
2 结 果 2.1 体重、Lee's指数和脂体比变化(表 1)饥饿组大鼠体重明显低于对照组(P < 0.01)。饥饿高脂组体重明显增加,但仍低于高脂对照组(P < 0.01),略高于基础对照组(P > 0.05)。饥饿组与对照组大鼠之间的Lee's指数和脂体比差异无统计学意义(P > 0.05)。
表 1 不同组别大鼠体重、Lee's指数和脂体比( ± s , n = 12) ± s , n = 12)
|
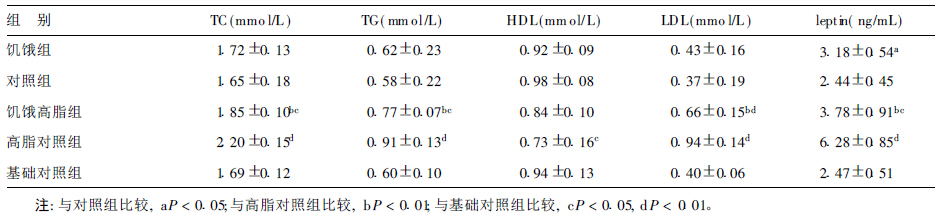
高脂干预6周后,饥饿高脂组血清TC、TG、LDL及leptin含量均明显低于高脂对照组 (P < 0.01),而高于基础对照组(P < 0.05),饥饿高脂组HDL含量与其他2组比较差异无统计学意义(P > 0.05)。
表 2 不同组别大鼠血脂和血清lept in水平(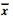 ± s, n = 12) ± s, n = 12)
|
光镜下可见,对照、基础对照及饥饿组肝脏组织结构完整,肝小叶清晰。高脂对照组肝小叶结构破坏,肝索排列紊乱,呈点、片状坏死,肝细胞肿胀明显,胞质内充满大量脂肪空泡,界限不清,细胞核固缩,可见炎细胞浸润并伴有肝细胞坏死。饥饿高脂组肝细胞肿胀明显减轻,可见散在炎细胞浸润,肝细胞内偶有小脂滴。
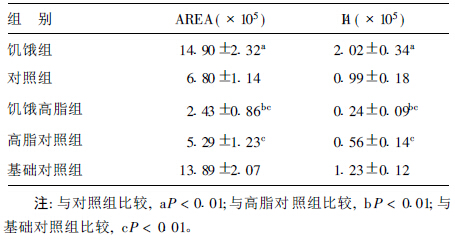
2.4 下丘脑NUCB 2表达水平(表 3)NUCB 2蛋白在弓状核、室旁核、视上核和下丘脑外侧区均有表达。第6周末,饥饿组大鼠下丘脑NUCB 2的阳性表达明显强于对照组(P < 0.01)。高脂干预6周后,饥饿高脂组下丘脑NUCB 2的阳性表达明显低于高脂对照组和基础对照组(P < 0.01)。
表 3 不同组别大鼠下丘脑NUCB 2表达( 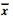 ± s, n= 12) ± s, n= 12)
|
重复性饥饿/再投喂是一种能使leptin对重复代谢性应激产生适应性反馈的独特实验方法〔1〕。经过这种饲喂方式处理的大鼠,较对照组体重减轻,但Lee's指数、脂体比和血脂水平却无明显差异〔3〕。leptin具有调节能量平衡减少脂肪沉积作用〔4〕,因而饥饿组血清leptin水平明显高于对照组,与本研究结果一致。饥饿组大鼠下丘脑NUCB 2的阳性表达亦明显高于对照组,提示与阿黑皮素原(POM C)在下丘脑弓状核协同表达的NUCB 2〔5〕可能具有与前者相似的生物学效应,引起大鼠摄食量减少,耗能量增加,进而导致体重减轻。饥饿高脂组大鼠血清leptin水平明显低于高脂对照组,表明高脂饮食引起的leptin抵抗得到了部分缓解。因为重复性饥饿/再投喂的应激刺激导致长时间的摄食不足,破坏了机体自身的能量平衡调节机制,使下丘脑的饱食中枢更容易引起兴奋或使饥饿中枢的敏感性降低,从而造成饥饿组大鼠在恢复正常给食高脂饲料后仍然比对照组摄取较少的能量,进而一定程度上降低了肥胖程度。同时伴随下丘脑极低浓度的NUCB 2,则可能是动物在摄食量相对不足的情况下维持基本生命功能的一种生理性适应反应〔6〕。本研究结果提示,leptin水平升高与NUCB 2表达增强、摄食量减少以及体重减轻有关,NUCB 2可能参与了大鼠体内leptin调节能量平衡以控制体重过程。
| 〔1〕 | Kmi YW,Scarpace PJ.Repeated fasting/refeeding elevates plasmalept in without increasing fat in rats[J].Physiol Behav,2003,78(3):459-464. |
| 〔2〕 | Oh-I S,Shmiizu H,Satoh T,et al. Identification of nesfatin 1 as a satiety molecule in the hypothalamus[J].Nature,2006,443(7112):709-712. |
| 〔3〕 | Kochan Z,Goyke E,Karbowska J,et al. The decrease of ratpost prandial plasma triglycerol concentration after multiple cycles of starvation-refeeding[J].Horm Metab Res,2001,33(1):26-29. |
| 〔4〕 | 瞿玲玲,姚兴家,王博,等.瘦素和神经肽YmRNA与肥胖抵抗的关系[J].中国公共卫生,2005,21(3):259-260. |
| 〔5〕 | Brailoiu GC,Dun SL,Brailoiu E,et al. Nesfatin 1:distribution and interaction with a G protein-coupled receptor in the rat brain[J].Endocrino logy,2007,148(10):5088-5094. |
| 〔6〕 | Park ES,Y iSJ,K mi JS,et al. Changes in orexin-A and neuropeptide Yexpression in the hypothalamus of the fasted and high-fat diet-fed rats[J].Vet Sci, 2004,5(4):295-302. |
 2010, Vol. 26
2010, Vol. 26