猪链球菌2型(Streptococcussuistype2,SS2)是一种重要的人兽共患病病原体,可引起猪的脑膜炎、关节炎和人的急性脑膜炎等,对集约化养猪业和相关从业人员造成伤害〔1, 2〕。猪链球菌荚膜血清型已达35种,多种血清型均有致病性,普遍认为猪链球菌2型(SS2)致病力最强〔3〕。猪链球菌的毒力因子主要有荚膜多糖(CPS)、溶菌酶释放蛋白(MRP)、胞外因子(EF)、谷氨酸脱氢酶(GDH)等。其中谷氨酸脱氢酶在进化上属于极为保守的蛋白,其编码基因在SS2中保守存在13-52,可以作为检测猪链球菌的重要诊断性抗原〔6〕。为探讨GDH在猪链球菌致病机制中的作用,并且建立相应新型检测方法,本研究扩增猪链球菌2型国内患者分离株和病猪分离株的GDH基因,对其进行T-A克隆、测序及序列分析,为进一步研究gdh提供基础依据。
1 材料与方法 1.1 材料(1)菌株及质粒:猪链球菌2型患者分离株(2007SF0165,分离自广州花都区人民医院患者,本室保存);病猪分离株(HA9801,华南农业大学惠赠);受体菌E.coliJM109、质粒pMD19-TVector(大连宝生物工程有限公司)。(2)试剂:PCR扩增试剂盒、T4DNA连接酶、DNA100bpmarker、PCR产物回收纯化试剂盒、X-gal、异丙基-B-D硫代乳糖苷IPTG、Amp(大连宝生物工程有限公司)。
1.2 方法 1.2.1 PCR 扩增gdh基因参照文献〔7〕设计合成引物,进行PCR扩增。上游引物(P1):5'-GTGGATCCATGTCAAATGCCAAAG-3';下游引物(P2):5'-GTTAGAGTCGACTTATACCAAACCTTGG-3';上游引物中引入BamHI酶切位点,下游引物中引入SalI酶切位点;预计扩增长度约为1300bp。PCR扩增条件为94℃60s;53℃60s;72℃90s,共30个循环。PCR产物经1%琼脂糖凝胶电泳,割胶称重经PCR产物回收纯化试剂盒回收,按说明书操作。
1.2.2 PCR产物TA克隆、鉴定及测序在微量离心管中配制pMD19-TVector1LL,InsertDNA0.1~0.3pmo,ldH2O补充至5LL,然后加入5LL溶液I,16℃反应30min;接着全量加入至100μL JM109感受态细胞中,冰中放置30min,42℃加热45s后,再在冰中放置1min。随后加入890μLSOC培养基,37℃振荡培养60min。最后,在含有X-Gal、IPTG、Amp的L-琼脂平板培养基上培养,形成单菌落,计数白色、蓝色菌落。挑选阳性重组菌即白色菌落,使用PCR法确认载体中插入片段的长度大小,委托上海生工生物工程技术有限公司测序。
1.2.3 gdh 基因序列分析gdh基测序结果在NCBI上进行BLAST分析,同时用软件DNAStar对测序结果和参考序列进行同源性分析和相应的谷氨酸脱氢酶GDH氨基酸序列进行预测分析。
2 结 果 2.1 PCR 扩增产物( 图 1)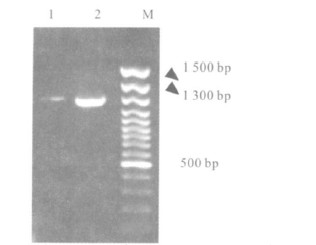 | 注: 1: 患者分离株2007 SF 0165; 2: 病猪 分离株HA 9801; M: m arker 100 bp。 图 1 gdh PCR 扩增产物 |
2株猪链球菌2型菌株的PCR 扩增产物经电泳后,均得到1 300 bp左右的目的条带,大小与 预测一致。
2.2 TA 克隆产物鉴定(图 2) | 注: 1: 空质粒pMD 19-T; 2: 患者分离株2007 SF 0165; 3: 病猪分离株HA9801; M: 100bpm arker。 图 2 克隆产物gdh PCR扩增鉴定 |
重组质粒转化JM109感受态细胞,经X-Gal、IPTG、Amp筛选得到阳性重组菌,挑选阳性重组菌,提取重组质粒作为模板,使用目的基因引物用PCR扩增法确认载体中插入片段的长度大小。含有目的基因的重组质粒均能扩增出1300bp左右的目的条带,而不含目的基因的空质粒不能扩增出目的条带,说明GDH基因片段已成功克隆。
2.3 gdh 测序结果和序列分析将测序结果两端的载体序列和部分引物序列去除后,得到1347bp的gdh基因全部序列,用软件分析预测可编码448个氨基酸。人源猪链球菌2型gdh基因序列GC含量为45.73%,猪源猪链球菌2型gdh基因序列GC含量为45.88%,猪链球菌2型gdh参考序列GC含量为45.81%。序列分析果显示,人源与猪源猪链球菌2型gdh序列同参考序列比较,人源猪链球菌2型在828处为T而参考序列为C,猪源猪链球菌2型在662处为C而参考序列为T。同参考序列比较,一致性均为99.9%。人源与猪源猪链球菌2型GDH序列仅相差2个碱基,具有GDH蛋白家族I的典型保守序列。
3 讨 论本研究通过TA克隆得到猪链球菌2型GDH基因,测序结果显示,不管是人源分离株,还是猪源分离株,与猪链球菌2型GDH参考序列相比,只有1个碱基不同,序列高度保守,并且GC含量均在45%左右。通过软件预测分析,发现它们编码的氨基酸序列具有GDH蛋白家族I的典型保守序列,应属于GDH蛋白家族Ⅰ。
谷氨酸脱氢酶在进化上是极为保守的一种蛋白质,是一 种重要的诊断性抗原,由于猪链球菌类型多样,毒力因子复杂 不一,且各毒力因子的致病机理和相互作用与关系仍未明确,对该病的诊断和防治仍缺乏有效手段。本文的研究结果为进 一步表达GDH 蛋白、研究GDH 蛋白功效、空间结构等提供理 论基础,为研究GDH 在猪链球菌致病机制中的作用,以及建 立猪链球菌检测方法等方面提供重要的参考价值〔8〕。
| 〔1〕 | Kopic J,Paradzik M T,Pandak N.Streptococcus suis infection as a cause of severe illness:two cases from Croatia[J].J Clin Microbiol, 2002,34(9):683-684. |
| 〔2〕 | Costa AT,Lobato FC,Abreu V L,et al. Serotyping and evaluation of the virulence in mice Strep tococcus suis strains isolated from diseased p igs[J].Rev Inst Med Trop Sao Paulo,2005,47(2):113-115. |
| 〔3〕 | Wisselink H J,Joosten JJ,Smith HE.Multiplex PCR assays for simul-taneous detection of sixmajor serotypes and two virulence associated phenotypes of Streptococcus suis in tonsillar specimens from pigs[J].J Clin Microbiol, 2002,40(8):2922-2929. |
| 〔4〕 | King S J,Leigh JA,Heath P J,et al. Development of a multilocus sequence typing scheme for the pig pathogen Strep tococcus suis: identification of virulent clones and potential capsular serotype exchange[J].J Clin Microbial, 2002,40(10):3671-3680. |
| 〔5〕 | Vela A,IGoyache J,Tarradas C,et al. Analysis of genetic diversity of Strep tococcus suis clinical isolates from pigs in Spain by pulsed field gelelectrophores is[J].J Clin Microbiol, 2003,41(6):2498-2502. |
| 〔6〕 | Okw umabuaO,Chinnap apakkagar S.Identification of the gene encoding a 38-kilodalton mimunogenic and protective antigen of Strep-tococcus suis[J].Clin Diagn Lab Immunol, 2005,4(12):484-490. |
| 〔7〕 | Okwum abua O,Persaud JS,Reddy PG.Cloning and characterization of the gene encoding the glutamate dehyd rogenase of Streptococcus suis serotype 2[J].Clin Diagn Lab Immunol, 2001,8(2):251-257. |
| 〔8〕 | 胡玉山,刘俊华,庞杏林,等.猪链球菌2型多重PCR鉴定方法建立[J].中国公共卫生,2009,25(5):574-575. |
 2010, Vol. 26
2010, Vol. 26
