2. 南方医科大学公共卫生与热带医学院流行病学系
诺如病毒( No rov ituses,NoV ) 又称诺瓦克样病毒( No rw alk-like v irus) )属于杯状病毒科诺如病毒属,是引起病毒性 急性胃肠炎暴发和散发的最重要病原体〔1〕NoV 属于单正链 RNA 病毒,基因组全长约717 kb,GC 含量48%,包括3个开 放读码框架( ORF)、3'端非编码区以及po ly A 区。其中 ORF2编码含530个氨基酸的主要衣壳蛋白( v irus particle 1,VP1)。该衣壳蛋白为N oV 抗原主要决定簇,同时负责与受 体结合,近年来已成为NoV 研究的热点〔2〕。本研究利用PCR 克隆技术对3 株G II-4型N oV ORF2片段进行扩增、克隆到T 载体并进行序列分析,为进一步研制NV s感染的诊断试剂及 防治疫苗药物提供基础依据。
1 材料与方法 1.1 粪便标本收集于广州和江门市病毒性腹泻监测患者。在南方医科大学流行病学实验室鉴定为G II-4型毒株,抽取3株GZ-55,GZ-121,JM-482用于实验研究〔3〕。
1.2 酶与试剂病毒RNA 提取采用Inv itrogen T rizo l提取,RNA 反转录试剂盒、PMD18-Tsim ple载体、高保真Pfx 酶( 日 本TaKaRa公司); dNTP、焦碳酸二乙酯、( DEPC) 、RNA inhib-i tor (美国Prom ega公司) 。异丙基-B-D-硫代乳糖苷、( IPTG)、 ( 德国Sigm a公司) 。
1.3 病毒RNA 的提取取1 g粪便样品加H ankps液10 mL ( 含庆大霉素8 000 U ),并彻底震荡使之悬浮; 4 ℃异丙基-B-D-硫代乳糖苷3 000 r/min离心20 min,取上清并保存在-70 ℃ 冰箱中备用。用Trizol从140 μL 粪便悬液中提取病毒 核酸、纯化20 LL RNA,保存于-70 ℃ ( 参照 iavitrogen 说明书)。
1.4 逆转录反应参照invitrogen说明书以提取的病毒RNA 为模板,应用随机引物在禽蛋白血病病毒( AMV) 逆转录酶的 作用下逆转录获得病毒cDNA,反应条件为30 ℃ 卵育10 min,42 ℃ 延伸30 min,99 ℃ 5 min,5 ℃ 5 min。
1.5 病毒ORF2 基因的克隆根据Genbank NOV G II-4 型 ORF2 基因序列,设计第一轮引物: 上游引物( 5057-5084,5'-TCGCAATCTGGCTCCCAGTTTTGTGAAT-3'); 下游引物( 6702-6728,5'-CCWGCWAAGAAAGCTCCAGCCATTAT-3')。以cDNA 为模板,利用高保真Pfx 酶扩增ORF2区域基因。PCR 反 应条件为: 94 ℃ 变性35 s,54 ℃ 退火35 s,72 ℃ 延伸2 min,35 个循环,72 ℃ 延伸10 min。PCR 结束后,扩增的特异性片段 经11 0%琼脂糖凝胶电泳。用TaRaKa Ge lEx traction K it回收 产物加A 碱基处理后克隆至PMD18-T s imp le 载体测序。并 依据测序结果利用DNAstar找到ORF2。然后利用Priem ier 5 程序设计引物。于上游加入Bam H I酶切位点( GGATCC ) 及 其保护性碱基序列( CG ),引物设计为: CGGGATCCATGAAGATGGCGTCGAAT; 下游加上Hind Ⅲ 酶切位点 ( AAGCTT)及其保护发生碱基序列( CCC ),确定第二轮引物 序列为: CCCAAGCTTTTATAAGGCACGTCTACGC。重复PCR、 电泳、PCR产物加A碱基处理并克隆到PMD18-T sim ple 载体,获得完整ORF2序列。
1.6 DNA序列测定和分析将扩增的片段与pMD18-T载体连接后,转化感受态细胞DH5a,挑白斑菌落进行PCR鉴定,得到含目标片段的重组阳性菌株,用于测序分析。序列测定由Invitrogen公司进行。全部核苷酸、氨基酸序列分析比较和进化树绘制利用DNAstar、ClustalX和Treeview软件完成。
2 结 果 2.1 NoV ORF2 基因的扩增、克隆与鉴定(图 1)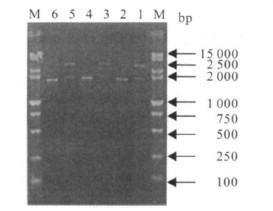 | 注: M: m aker; 1: GZ55 号标本双酶切产物; 2: GZ55 号标本PCR 产物; 3: GZ121 号标本双酶切产物; 4: GZ121标本PCR产物; 5: JM 482 标本双酶切产物; 6: DM 482标本PCR产物。 图 1 NoV OREF2 基因琼脂糖凝胶电泳 |
根据Gen-Bank公布的GII-4型NoV保守序列设计合成特异性引物,3株GZ-55,GZ-121,JM-482标本通过RT-PCR均得到约117kb大小ORF2区域片断,其长度与预计相符。将PCR产物克隆至T载体并测序。测序结果显示,该克隆片段为包含GII-4型NoVORF2基因的序列。依据第1轮设计第2轮引物(引入BamHI、HindIII酶切位点)并PCR扩增出完整ORF2序列(约1162kb),并克隆到PMD18-TSimple载体,结果证实,3株标本均获得了正确的GII-4型NoVORF2基因。
2.2 NoV ORF2 氨基酸序列进化树构建(图 2)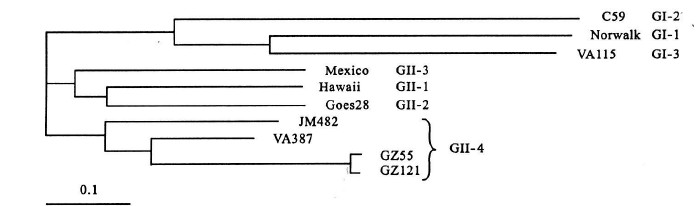 | 图 2 NoV OREF2 氨基酸序列进行划数构建 |
利用C lustX 118软件,以NJ( Ne ighbor jo ining )方法,选取代表性NoV G I、 GII的ORF2氨基酸,和本研究中3株NoV构建了ORF2氨基 酸序列进化树,以TreeV iew3.2显示进化树。
2.3 NoV ORF2 序列分析(图 3)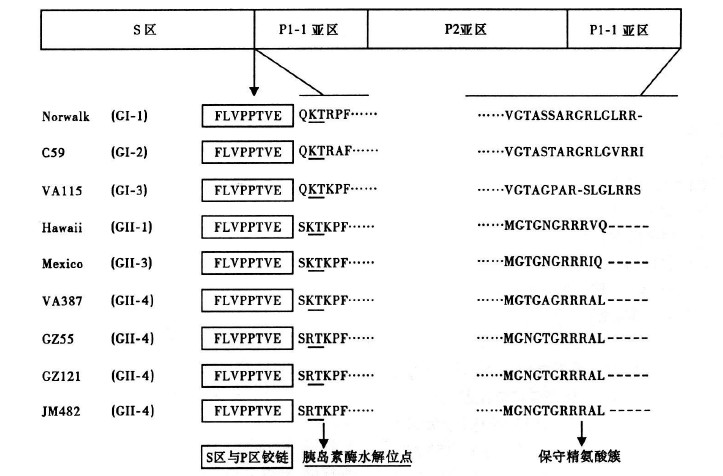 | 图 3 3株GII-4型 NOV 与不同型别NOV 氨基酸队列对比 |
利用DNAstar软件分析3 株NoV ORF2 序列,其中GZ55、GZ121 ORF2共1620 个碱基 编码539个,JM 482 ORF2共1623 个碱基编码540个氨基酸,3株ORF2编码的氨基酸大小约为54KD。。GZ55、GZ121 和 JM 482与VA387氨基酸同源性为别为92%,93%,93%。与 Genband代表NoV G I、GII的ORF2氨基酸比较分析。结果表 明: NoV ORF2包括2 个主要区域,N 端结尾的壳区域( S 区 域)和C端结尾的突出区域( P区域); 其编码的氨基酸序列 存在3 个相对保守序列。
3 讨 论本研究利用GenbankNoVGII-4型ORF2基因序列成功设计2对引物,扩增了ORF2并引入BamHI、HindIII酶切位点克隆到T载体。由于杆状病毒表达系统中载体pfastBac1亦存在BamHI、HindIII酶切位点,将直接可以用于病毒颗粒(VLPs)表达〔4〕。NoVORF2编码NoV主要结构蛋白(vpl),是抗原主要决定簇,并负责识别宿主受体。衣壳蛋白VP1可以划分为2个区域。分别为衣壳蛋白中间的S区域和向外突出的P区域。N末端的225个氨基酸构成了VP1的S区域和对形成二十面体蛋白衣壳必须的基序。其他的氨基酸则构成P区域。P区域可分为P1和P2两个主要的亚区。P1亚区与NoV的抗原性有关,而P2区域被认为是与细胞受体结合有关。不同基因型ORF2编码的衣壳蛋白氨基酸序列变异可达到60%,即使同一基因型内变异也可以达到20%~30%〔2〕。
虽然NoVORF2高度变异尤其是P2亚区,然而本研究中对克隆的3株GII-4与不同型别NoV序列比对中发现,ORF2亦存在一些相对保守区域,现已证实这些保守序列均具有不同的重要作用:(1)S区与P区结合部位的FLVPPTVE在GI、GII型中均高度保守。FLVPPTVE序列为一铰链序列,利用大肠埃希菌表达系统或酵母表达系统P区域可以在体外表达2种形式的P蛋白:含FLVPPTVE铰链的P二聚体和不含铰链T=1二十面体的P颗粒。P二聚体和HBGAs受体结合力低,而P颗粒结合HBGAs受体能力非常强,是P二聚物的700倍以上;甚至于超过了VLPs结合HBGAs受体的能力,为其3倍〔4, 5〕。(2)相对保守的P1亚区KT或RT氨基酸序列,现被证实为胰岛素酶切位点。NoV感染进入胃肠道组装的衣壳蛋白被胃肠道胰岛素酶切位点。NoV感染进入胃肠道组装的衣壳蛋白被胃肠道胰岛素酶水解后形成P多肽。有研究在病人的粪便中检测到P多肽,证实了该胰岛素酶切位点的存在〔6〕。(3)P区域C末端保守精氨基酸R簇在GI、GII中均存在。有研究表明,C末端保守精氨基酸R簇在识别受体过程是必需的〔6〕。
| 〔1〕 | Estes M K,Prasad BV,Atmar R L.Noroviruses everywhere:has something changed[J].Curr Opin Infect Dis,2006,19(5):467-474. |
| 〔2〕 | Hardy M E.Norovirus protein structure and function[J],FEMS Microbiol Lett,2005,253(1):1-8. |
| 〔3〕 | 戴迎春,刘翼,詹惠春,等.2003-2005年度广州儿童秋冬诺如病毒检测结果分析[J].中国公共卫生,2009,25(1):102-103. |
| 〔4〕 | Tan M,Fang P,Chachiyo T.Noroviral Pparticle:structure,function and applications in virus-hostin teractions[J].Virology,2008,382 (1):115-123. |
| 〔5〕 | Tan M,Hegde R S,Jiang X.The Pdomain of norovirus capsid protein forms dimer and binds to histo-blood group an tigen receptors[J].J Virol, 2004,78(12):6233-6242. |
| 〔6〕 | Tan M,Meller J,Jiang X,C-terminal arginine cluster is essential for receptor binding of norovirus capsid protein[J].J Virol, 2006,80 (15):7322-7331. |
 2010, Vol. 26
2010, Vol. 26

 , 吕志平1
, 吕志平1