生物活性肽( b ioac tive peptides) 是指对生物体的生命活动有益或具有生理作用的肽类化合物。相对于蛋白质,活性肽分子小,但生物活性高,少量的肽就能发挥非常重要的生理作用〔1〕。本实验室之前的研究发现,以无污染的深海鱼肉组织为原料,采用生物酶解的方法产生的海洋蛋白肽(M a rine pro tein pep tide,M PP) ,具有增强小鼠免疫功能的作用〔2〕。此外,许多研究发现,单独给予核苷酸( N uc leo tides,NT ),也具有增强机体免疫力的作用〔3, 4〕。因此,本研究探讨M PP和 NT配伍剂对小鼠的免疫调节作用及其作用机制,旨在为新型保健食品的开发提供科学依据。
1 材料与方法 1.1 受试物海洋蛋白肽( 北京中食海氏生物技术有限公司) ; 核苷酸( 5 'AMP:5' CMP:5'GMPNa2 :5'UMPNa2 = 22.8: 25.8:30.2:20.4) ( 大连珍奥集团股份有限公司)。
1.2实验动物Balb/ c 健康雌性小鼠,清洁级,合格证号: SCXK(京) (北京大学医学部实验动物中心); 6~ 8周龄,18~ 22 g。共160只,分为4批进行实验,每批随机分为4组,每组 10只。实验Ñ 批进行脏器/体重比值测定、迟发型变态反应实验、半数溶血值( HC50 )的测定和抗体生成细胞数的测定; 实验Ò 批进行碳粒廓清实验; 实验Ó 批进行小鼠腹腔巨噬细胞吞噬鸡红细胞实验; 实验Ô批进行刀豆蛋白A ( ConA )诱导的小鼠淋巴细胞转化实验、杀伤细胞( NK )活性、脾脏T淋巴细胞百分比和血清免疫球蛋白水平测定。
1.3 主要仪器与试剂B io-Rad 酶标仪( 美国B io-Rad 公司); 二氧化碳培养箱( 日本SANYO 公司); FACSCa libur型流式细胞仪(美国BD公司) 。刀豆蛋白( ConA )、四甲基偶氮噻唑蓝(MTT)、琼脂糖、十二烷基硫酸纳( SDS ) ( 美国Sigm a 公司); 胎牛血清、RPM I 1640培养液(美国H y clone 公司); 藻红蛋白( PE)标记的抗小鼠CD4单抗、别藻蓝蛋白( APC) 标记的抗小鼠CD8单抗、异硫氰酸荧光素( FITC )标记的抗小鼠CD3 单抗(美国Inv itrog en公司) ; 绵羊红细胞( SRBC ) ( 北京大学医学部实验动物中心) ; 免疫球蛋白试剂盒( 北京德易生物医学技术有限公司)。其余试剂均为分析纯。
1.4 实验方法 1.4.1 剂量分组及给药方法海洋蛋白肽(MPP)的推荐剂量为成人( 按60 kg 体重计) 每日217 g,相当于0.045 g / ( kg· bw )。核苷酸( NT) 的成人每日推荐摄入量为核苷酸 0.020 g /( kg· bw )。按照2个受试物单独作用的最佳剂量〔2〕 配伍设核肽混合中剂量组,再上下各设一核肽混合高和低剂量组,另设一空白对照组。空白对照组: 给予普通饲料; 高剂量组: 0.120 g /( kg· bw ) 核苷酸+ 0.675 g / ( kg· bw )海洋蛋白肽,即每100 g饲料含NT和M PP各01 120和0. 675 g; 中剂量组: 0.040 g /( kg· bw) 核苷酸+ 0.225 g / ( kg· bw ) 海洋蛋白肽,即每100 g 饲料含NT和MPP各0.040和0.225 g; 低剂量组: 0.013 g / ( kg· bw )核苷酸+ 0.075 g / ( kg· bw ) 海洋蛋白肽,即每100 g饲料含NT和MPP各0.013和0.075 g。
1.4.2 免疫调节实验实验动物饲养于北京大学医学部实验动物中心二级动物室,温度20 ~ 25 ℃ ,相对湿度40% ~ 50%,24 h人工昼夜( 7~ 19时昼,19 ~ 7 时夜) 。各组小鼠喂饲不同饲料4周后,称重后颈椎脱臼处死,各免疫调节指标测定按5保健食品功能学评价程序及检验方法6中免疫调节功能的评价方法〔5〕进行。
1.4.3 流式细胞仪检测小鼠脾脏T细胞亚群百分比〔6, 7〕实验4周后,小鼠颈椎脱臼处死,取脾脏,磨碎,过滤( 200 目) ,洗涤,裂解红细胞,悬浮,制备成细胞浓度为1×106 个/mL脾细胞悬液。每份样品编3 支试管,每管加上述脾单细胞悬液1 mL,离心弃上清,加1 mL磷酸盐缓冲液( PBS ) ( pH 71 0) 洗涤2次,再按组分别加入荧光标记的抗小鼠的各种CD单克隆抗体(按试剂说明书操作),室温( 18~ 25℃ ) 避光孵育15 m in,进行染色。然后再用PBS 洗2次,加入PBS 300 LL,上机,按使用说明书用流式细胞仪检测各细胞群百分比。
1.4.4 血清免疫球蛋白水平测定血清中免疫球蛋白IgG、 IgM、IgA的测定,采用琼脂内单向免疫扩散法。
1.5 统计分析采用SPSS 1110统计软件进行方差分析。
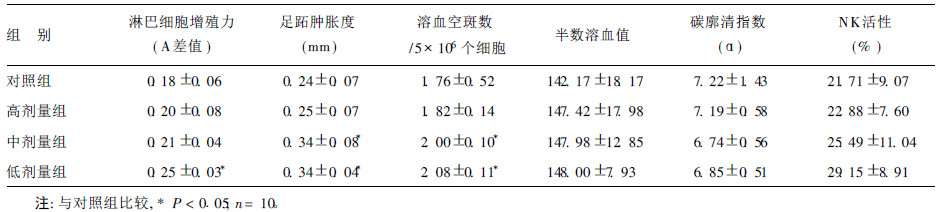
2 结果 2.1 海洋蛋白肽和核苷酸配伍剂对小鼠各项免疫功能指标的影响(表 1)| 表 1 海洋蛋白肽和核苷酸配伍剂对小鼠各项免疫功能指标的影响( |
由表 1可见,经口给予小鼠不同剂量的混合物4周后,与正常组比较,混合物低剂量组能明显增强ConA 诱导的小鼠淋巴细胞转化能力(P < 0.05),中、低剂量组能明显增强小鼠迟发型变态反应能力( P < 0.05),能明显提高小鼠抗体生成细胞数( P < 0.05)。
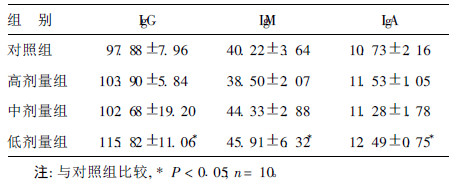
2.2 海洋蛋白肽和核苷酸配伍剂对小鼠血清免疫球蛋白分泌的影响(表 2)| 表 2 海洋蛋白肽和核苷酸配伍剂对小鼠免疫球蛋白分泌的影响( |
由表 2 可见,经口给予小鼠不同剂量的混合物4周后,与正常对照组比较,低剂量组的血清免疫球蛋白 IgG、IgM 和IgA水平均明显升高( P < 0.05),即二者配伍具有增加抗体生成作用。
2.3 海洋蛋白肽和核苷酸配伍剂对小鼠脾脏T 细胞亚群百分比的影响(表 3)| 表 3 海洋蛋白肽和核苷酸配伍剂对小鼠脾脏
淋巴细胞群百分比的影响( |
由表 3可见,给予不同剂量混合物4周后,与对照组比较,低剂量组的小鼠脾脏CD4+ T细胞亚群百分比明显增加( P < 0.05) ; 3 个剂量组的脾脏细胞CD4+ / CD8+ 的比值均明显增加(P < 0.05); 高剂量组的脾脏CD8+ T 细胞亚群百分比明显降低(P < 0.05)。提示混合物可能通过增强CD4+ T 辅助细胞( Th细胞)功能,以及抑制CD8+ T 抑制细胞( T s细胞)功能而实现增强免疫功能的作用。
3 讨论本研究海洋蛋白肽是以无污染的深海鱼肉组织为原料,采用生物酶解的方法生产,由2~ 6个氨基酸组成、分子量范围在200~ 1 000 D 的小分子混合寡肽类。而核苷酸是以蔗糖糖蜜为原料发酵提取RNA,再经酶降解生产的纯度在99% 以上的5'核苷酸混合物。
本实验室之前的研究发现,单独给予MPP或NT,均具有增强免疫力的作用〔2〕。本次研究发现,经口给予小鼠不同剂量的M PP或NT配伍剂4周后,能够增强小鼠的细胞免疫及体液免疫功能,且混合物的最佳剂量低于二者单独作用的剂量,提示二者具有一定的协同作用。
研究证实,T淋巴细胞亚群是反映机体免疫系统内环境稳定状况的重要指标〔8〕。本实验中,三标染色流式细胞仪测定小鼠脾T 淋巴细胞亚群发现,M PP和NT 配伍剂可能通过增强CD4+ T辅助细胞( Th细胞)功能而实现增强免疫功能的作用。此外,补充配伍剂后可明显增加血清免疫球蛋白IgG、 IgM 和IgA的水平,提示配伍剂可能通过促进体内抗体生成从而提高机体免疫功能,但其作用机制有待进一步研究。
| 〔1〕 | Meisel H.Food-derived bioactive proteins and peptides as potential components of nutraceuticals[J].Current Phamraceutical Design,2007,13(9):873-874. |
| 〔2〕 | 杨睿悦,张召锋,裴新荣,等.海洋蛋白肽对小鼠免疫调节作用的实验研究[J].中华预防医学杂志,2008,42(4):221-225. |
| 〔3〕 | Gil A.Modulation of the mimune response mediated by dietary nucleotides[J].European Journal of Clin ical Nutrition,2002,56(Suppl 3):S1-S4. |
| 〔4〕 | Yamamoto S,Wang M,Adjei A,et al. Role of nucleosides and nucle-otides in the mimune system,gu treparation after in jury,and brain function[J].Nutrition,1997,13:372-374. |
| 〔5〕 | 中华人民共和国卫生部.保健食品检验与评价技术规范[S].北京:卫生部,2003. |
| 〔6〕 | Guo TL,McCay JA,Brown RD,et al. Glycidol modulation of the immuneresponses in female B6C3F1 mice[J].Drug Chem Toxicol,2000,23:433-457. |
| 〔7〕 | Wmiolnut A,Benjamart C,Vanessa P,et al. Immunom odulation by Dok Din Daeng(Aeginetia indica Roxb.)extracts in female B6C3F1 mice(I):stmiulation of Tcells[J].Int Immunopharmacol,2004,4:1367-1379. |
| 〔8〕 | Syrijala H,Surcel HM,Ilonen J.Low CD4/CD8 lym phocyte ratio in acute myocardial in farct[J].Clin Exp Immunol, 1991,83:326-328. |
 2010, Vol. 26
2010, Vol. 26