糖尿病性视网膜病变(DR)是糖尿病的主要并发症之一,是糖尿病引起失明的最主要病因。DR的主要治疗方法是控制血糖和视网膜光凝,但一些患者在经过上述治疗后,视网膜病变仍然继续进展。DR是一种慢性炎症性疾病,一氧化氮(NO)参与了糖尿病视网膜微血管损伤的病理过程〔1〕。牛磺酸为小分子的含硫氨基酸,是视网膜中含量最丰富的游离氨基酸,具有调节渗透压、稳定细胞膜、抗氧化损伤等多种生理作用〔2〕。研究发现,牛磺酸通过抑制核转录因子(NF-κB)的活化减少NO的释放,减轻炎症反应〔3〕,对糖尿病具有潜在的治疗作用〔4〕。本研究探讨牛磺酸对糖尿病视网膜组织中一氧化氮及其合酶(NOS)的影响,观察牛磺酸对糖尿病性视网膜病变的改变作用。
1 材料与方法 1.1 实验动物及分组选用封闭群雄性SD大鼠(华中科技大学同济医学院实验动物中心)24只,体重200~250 g。单笼喂养,自由进食饮水,自然昼夜光线照明。随机选取8只大鼠作为正常对照组,将造模成功的糖尿病大鼠16只随机分成2组即糖尿病组及牛磺酸干预组,分别饲以标准颗粒饲料及添加1.2%牛磺酸饲料。
1.2 主要仪器及试剂Surestep血糖仪及试纸(美国强生公司);DiastixTM尿糖试纸(澳大利亚Bayer公司),UV751GD紫外可见光光度计;Olympsu IX71型显微镜(日本Olympsu公司)。链脲佐菌素(STZ,美国Sigma公司)。NO测试盒、nNOS及iNOS免疫组化染色试剂盒(武汉博士德生物制品公司)。
1.3 糖尿病模型的建立动物注射药物前禁食12 h,自由饮水。用链脲佐菌素诱导大鼠糖尿病,临用前用0.1 mmol/L (pH 4.5)的柠檬酸-柠檬酸钠缓冲液配制成1%的STZ溶液,按60 mg/(kg·bw)一次性腹腔注射STZ,注射后72 h取尾静脉血及尿液,采用葡萄糖氧化酸法测定血糖和尿糖。血糖浓度>16.7 mmol/L、尿糖在(+ + +)以上者即为模型建立成功。对照组腹腔注射等量的柠檬酸钠缓冲液。
1.4 组织取材及视网NO含量的测定动物处死后立即摘除双侧眼球,一侧眼球测定视网膜NO含量,另一侧眼球进行视网膜组织化学染色。测定NO的眼球置入冰袋上,解剖显微镜下沿角膜缘后1 mm剪开眼球,弃去眼前节及玻璃体,分离视网膜神经上皮层,分析天平上称重后,用冰生理盐水制成10%的组织匀浆。采用硝酸还原学法用分光光度计测定视网膜组织匀浆中NO含量。
1.5 nNOS及iNOS测定采用S-ABC眼球摘除后置于4%多聚甲醛中固定24 h,石蜡包埋,常规切片脱蜡,3%过氧化氢孵育,热修复抗原,正常山羊血清封闭,分别加入nNOS或iNOS特异性抗体,4 ℃过夜,滴加生物素化羊抗小鼠IgG,置温盒内37 ℃保温20 min,滴加免疫组化染色(SABC)试剂,磷酸盐缓冲液(PBS)冲洗,二甲基氨基偶氢苯(DAB)显色,镜下观察,水洗中止反应,苏木素复染,脱水,透明,封片。阳性结果以胞浆及胞核内出现棕黄色或黄色颗粒为准。切片在Olympus IX71型显微镜下数码拍照,分别随机抽取各组视网膜组织切片3张,每张随机取5个高倍镜视野,医学图像分析系统Image-Pro Plus 6.0检测吸光度(A)值。
1.6 统计分析采用SPSS 15.0统计软件进行方差分析,最小显著差法(LSD)进行样本均数的两两比较。
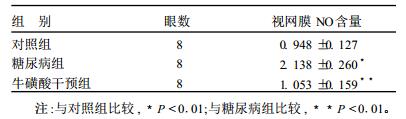
2 结果 2.1 不同组别大鼠视网膜NO含量检测(表 1)| 表 1 各组视网膜NO含量检测结果(μmol/L) |
糖尿病组视网膜NO含量明显高于对照组(P < 0.01),而牛磺酸干预组视网膜NO含量低于糖尿病组(P < 0.01)。
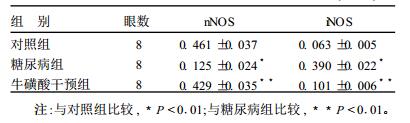
2.2 不同组别大鼠视网膜nNOS及iNOSA值测定(表 2)| 表 2 各组视网膜nNOS及iNOSA值测量结果(x±s) |
nNOS阳性细胞在各组大鼠视网膜内均有分布,并集中于内核层和节细胞层,对照组阳性细胞较多。与对照组nNOS阳性细胞A值(0.461±0.037)比较,糖尿病组nNOS阳性细胞A值明显减少,其平均数为(0.125±0.024),2组差异有统计学意义(P < 0.01);而牛磺酸干预组nNOS阳性细胞A值(0.429±0.035),无明显下降,高于糖尿病组(P < 0.01)。糖尿病组视网膜厚度变薄,内丛状层变化较明显。对照组大鼠内核层和节细胞层内iNOS阳性细胞很少,阳性细胞平均A值为(0.063±0.005),而糖尿病组及牛磺酸干预组视网膜iNOS阳性细胞增加。糖尿病大鼠视网膜内iNOS阳性细胞A值为(0.390±0.022),与对照组比较,明显升高,差异有统计学意义(P < 0.01)。虽然牛磺酸干预组视网膜iNOS阳性细胞A值与对照组相比也增加,但其A值(0.101±0.006)要比糖尿病组的(0.390±0.022)低很多(P < 0.01)。
3 讨论NO是一种重要的细胞间信号分子,由氧分子和L -精氨酸通过NOS催化产生。nNOS产生生理浓度的NO,调节细胞活力和维持血管功能,可减轻糖尿病引起的血管内皮和神经细胞损伤。iNOS在炎症症介质诱导下产生,释放大量NO,导致神经变性和细胞凋亡,引起严重的眼病〔1〕。糖尿病是一种具有慢性炎症特征的疾病。nNOS阳性细胞在正常大鼠视网膜组织广泛存在,随着糖尿病病程的发展而减少;而iNOS阳性细胞在正常大鼠视网膜几乎不存在,患糖尿病后增多,nNOS与iNOS活性的变化对糖尿病视网膜的炎性损伤具有调控作用〔5〕。本研究结果显示,12周糖尿病大鼠视网膜NO的含量增加,内核层和节细胞层内iNOS阳性细胞A值增加,nNOS阳性细胞A值减少,iNOS与nNOS共同作用使视网膜损伤变薄。
牛磺酸是脑、视网膜中含量很丰富的自由氨基酸,具有抗氧化、调控炎症反应等多种生理作用,可下调糖尿病大鼠视网膜中神经胶质原纤维酸性蛋白(GFAP)及mRNA的表达,减轻视网膜损伤〔6〕。试验表明,牛磺酸对糖尿病具有治疗作用〔7〕。牛磺酸通过抑制核转录因子NF-κB的活化,阻止iNOS的表达,从而减轻炎症反应〔3〕。本研究发现,牛磺酸可以减少糖尿病视网膜一氧化氮的含量,阻止nNOS的下降,减少iNOS的表达,进而对视网膜具有保护作用。
| [1] | Toda N, Nakanishi-Toda M. Nitric oxide:ocular blood flow, glaucoma, and diabetic retinopathy[J]. Prog Retin Eye Res, 2007, 26(3) : 205–238. DOI:10.1016/j.preteyeres.2007.01.004 |
| [2] | Zeng K, Xu H, Mi M, et al. Dietary tauine supplemintation prevents glial alterations in retina of diabetic rats[J]. Neurochem Res, 2009, 34(2) : 244–253. DOI:10.1007/s11064-008-9763-0 |
| [3] | Barua M, Liu Y, Quinn MR. Taurine chloram ineinhibits inducible nitric oxide synthase and TNF-alpha gene expression in activated alveolar macrophages:decrease dNF-kappsB activation and IkappaB kinase activity[J]. J Immunol, 2001, 167(4) : 2275–2281. DOI:10.4049/jimmunol.167.4.2275 |
| [4] | Franconi F, Loizzo A, Ghirlanda G, et al. Taruine supplementation and diabetes mellitus[J]. Curr Opin Clin Nutr Metab Care, 2006, 9(1) : 32–36. DOI:10.1097/01.mco.0000196141.65362.46 |
| [5] | 刘庆淮, 谢戈袁. 一氧化氮及其合酶在糖尿病视网膜损伤中的作用[J]. 中华眼科杂志, 2005, 41(09) : 837–841. |
| [6] | 徐朝霞, 糜漫天, 许红霞. 牛磺酸对糖尿病大鼠视膜的保护作用[J]. 中国公共卫生, 2005, 21(8) : 950–953. |
| [7] | Kern TS. Contributions of inflammatory processes to the development of the early stages of diabetic retinopathy[J]. Exo Diabetes Res, 2007, 2007 : 1–14. |
 2009, Vol. 25
2009, Vol. 25