2. 大连医科大学中日永和医药研究所;
3. 辽宁出入境检验检疫局
3-氯-1, 2-丙二醇(3-monochloropropane-1, 2-di-ol, 3-MCPD)是食品污染物氯丙醇类化合物中最常见的代表物质, 它已经在许多食品和食品原料中被检测到, 主要存在于利用酸水解植物蛋白质加工而成的酱油、蚝油等调味品、方便食品以及某些保健食品中〔1〕, 而一些家庭自制的高温加工的谷类制品如面包、奶酪等在烘烤焙过程中氯丙醇污染水平也有升高〔2〕。研究表明, 3-MCPD是一种鼠类致癌物, 具有免疫毒性、生殖毒性、神经毒性, 体外试验显示具有致突变性〔3〕。本研究选用3-MCPD在较低剂量水平(≤10 mmol/L)时, 探讨3-MCPD致人胚肾293(HEK293)细胞DNA损伤及作用机制。
1 材料与方法 1.1 材料(1)细胞系:HEK293细胞ATCC CRL-1573(美国菌种保藏中心)。(2)主要试剂:3-MCPD, 无色似油状液体(美国Alfa Aesar公司), 纯度>98%。3-MCPD以三蒸水溶解, 贮存液浓度为1000 mmol/L, 4℃保存。临用时用培养液稀释至所需浓度。胎牛血清(DMEM)培养基、胎牛血清(美国GIBCOBRL公司); 低熔点琼脂糖(LMA)、正常熔点琼脂糖(NMA)(英国GibcoBRL公司); 二甲基亚砜(DMSO)、RNAseA、2′, 7′-二氢二氯荧光素二乙酸酯(DCFH-DA) (美国Sigma公司); 抗8-羟基脱氧鸟苷(8-OHdG)单克隆抗体(日本JaICA公司); UltraSensitiveTMS-P超敏试剂盒、二氨基联苯胺(DAB)显色试剂盒(福州迈新生物技术开发有限公司); 其他试剂均为分析纯。(3)主要仪器:CO2培养箱(美国FORMA公司); 3550型酶标仪(美国BIO-RAD公司); 28M型超速离心机(美国BECKMAN公司); MRX-152型冷冻高速离心机(日本TOMY公司); JY2002型电子天平、FA2004型电子分析天平(上海精密科学仪器有限公司); JM250型水平式电泳仪(大连捷迈公司); 650-60型荧光分光光度计(日本HITACHI公司); CK2型倒置显微镜、BX51型荧光显微镜(日本Olympus公司)。
1.2 方法(1)单细胞凝胶电泳(SCGE)试验:参照文献〔4〕。(2)细胞内活性氧(ROS)测定:参考文献〔5〕方法, 采用荧光探针DCFH-DA测定3-MCPD作用于HEK293细胞后产生的细胞内ROS。(3)细胞内8-羟基脱氧鸟苷(8-OHdG)免疫组化分析:参照文献〔6〕方法略加改动。显微镜下阅片, 应用Image-proplus4.5.1图像(A)分析系统进行定量图像分析, 观察50个随机选择的细胞, 用测得的吸光度值〔7〕(数值放大1000倍)表示8-OHdG阳性表达的相对强弱。
1.3 统计分析采用SPSS 11.5软件进行分析, 2组间均数比较采用单因素方差分析。
2 结果 2.1 -MCPD对HEK293细胞DNA的影响(表 1)| 表 1 3-MCPD诱导对HEK293细胞DNA影响(x±s) |
彗星试验(SCGE)结果显示, 1.25, 2.5, 5, 10 mmol/L的3-MCPD与HEK293细胞接触1 h后, HEK293细胞呈现彗星样拖尾, 随着剂量的增加, 拖尾现象更明显, 彗星样细胞的尾部DNA (%)明显大于对照组(P < 0.05), 且呈剂量依赖关系。
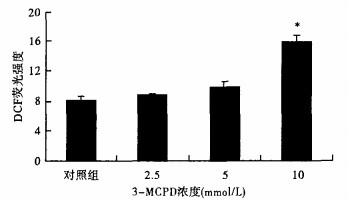
2.2 -MCPD对HEK293细胞内ROS水平的影响(图 1)
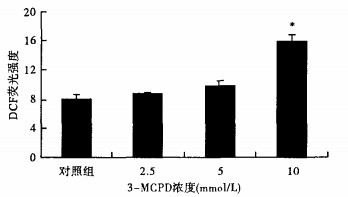
|
注:与对照组比较,*P < 0.05。 图 1 3-MCPD对HEK293细胞内ROS水平的影响 |
2.5~10 mmol/L 3-MCPD与HEK293细胞接触1 h后, 3-MCPD在2.5和5 mmol/L的浓度时, ROS生成量与对照组比较差异无统计学意义。随着3-MCPD浓度的增高, 细胞内ROS生成量增加, 3-MCPD浓度至10 mmol/L时, 细胞内ROS水平明显高于对照组(P < 0.05)
2.3 3-MCPD对HEK293细胞内8-OHdG表达水平的影响(图 2)
|
注:与对照组比较, P < 0.05。 图 2 3-MCPD对HEK293细胞内8-OHdG表达水平的影响 |
经免疫组化染色后, 在显微镜下观察, 8-OHdG阳性物质呈棕黄色, 主要集中在细胞核中, 细胞核的着色随3 -MCPD剂量的增高而加深, 经定量分析, HEK293细胞核的平均吸光度值, 在1.25 mmol/L 3-MCPD时无变化, 随着3-MCPD浓度的增大, HEK293细胞核的平均吸光度值增高, 在2.5和5 mmol/L时, HEK293细胞核的平均吸光度值与对照组比较差异有统计学意义(P < 0.05)。
3 讨论SCGE试验是最近几年发展起来的一种灵敏且可靠的检测单个细胞核DNA损伤技术〔8〕。本研究采用此方法检测3 -MCPD对HEK293细胞的DNA损伤作用。结果表明, 1.25~10 mmol/L的3-MCPD可诱发HEK293细胞的DNA链断裂, 提示3-MCPD可导致HEK293细胞的DNA损伤。结果表明, 3-MCPD能引起细胞内ROS水平的上升, 而且在浓度为10 mmol/L时, HEK293细胞内ROS的生成量明显增加。随着3-MCPD剂量水平的上升, HEK293细胞内8-OhdG表达水平逐渐升高, 在2.5和5 mmol/L时细胞内8-OHdG表达水平明显升高。提示3-MCPD导致了ROS水平的升高, 并进一步造成HEK293细胞的氧化性损伤。
综上所述, 3-MCPD通过诱导HEK293细胞内ROS水平的升高, 产生氧化应激反应, 进一步造成氧化性DNA损伤, 表明3-MCPD对HEK293细胞的DNA损伤很有可能与氧化性DNA损伤机制有关。
| [1] | Macarthur R, Crews C, Davies A, et al. 3-Monochloropropane-1, 2-diol (3-MCPD) in soy sauce and similar products available from retail outlets in the UK[J]. Food Addit Contam, 2000, 17 : 903–906. DOI:10.1080/026520300750038072 |
| [2] | Crews C, Brereton P, Davies A. The effects of domestic cooking on the levels of 3-monochloropropanediol in foods[J]. Food Addit Contam, 2001, 18 : 271–280. DOI:10.1080/02652030120064 |
| [3] | Cho WS, Han BS, Nam KT, et al. Carcinogenicity study of 3-monochloropropane-1, 2-diol in Sprague-Dawley rats[J]. Food Chem Toxicol, 2008, 46 : 3172–3177. DOI:10.1016/j.fct.2008.07.003 |
| [4] | Singh NP, Stephens RE. Microgel electrophoresis: sensitivity, mechanisms, and DNA electrostretching[J]. Mutat Res, 1997, 383 : 167–175. DOI:10.1016/S0921-8777(96)00056-0 |
| [5] | Sohn JH, Han KL, Lee SH, et al. Protective effects of panduratin A against oxidative damage of tertbutylhydroperoxide in human HepG2 cells[J]. Biol Pharm Bull, 2005, 28 : 1083–1086. DOI:10.1248/bpb.28.1083 |
| [6] | Yarborough A, Zhang YJ, Hsu TM, et al. Immunoperoxidase detection of 8-hydroxydeoxyguanos in einaflatoxin B1-treated rat liver and human oral mucosal cells[J]. Cancer Res, 1996, 56 : 683–688. |
| [7] | Romano G, Sgambato A, Mancini R. 8-hydroxy-2′-deoxyguanosine in cervical cells:correlation with grade of dysplasia and human papillomavirus infection[J]. Carcinogenesis, 2000, 21(6) : 1143–1147. DOI:10.1093/carcin/21.6.1143 |
| [8] | 董淑芳, 卢明俊, 单毓娟, 等. 铅诱导小鼠细胞DNA损伤的彗星试验研究[J]. 中国公共卫生, 2005, 21(7) : 853. |
 2009, Vol. 25
2009, Vol. 25

