2. 四川大学华西公共卫生学院;
3. 北京市疾病预防控制中心
大肠埃希菌易引起机会性感染, 作为动物和人类肠道中的正常菌群, 是耐药基因的储存库, 在细菌耐药性传播中发挥着重要作用〔1〕。整合子是一类具有俘获、切除和表达耐药基因盒功能的可移动元件, 其中Ⅰ类整合子与肠杆菌科的耐药性密切相关〔2〕。为探讨健康人肠道大肠埃希菌携带Ⅰ类整合子情况和分子特性, 分析其与细菌耐药性关系, 于2004年11月-2005年3月对北京市健康人群粪便标本分离的150株大肠埃希菌进行检测。结果报告如下。
1 材料与方法 1.1 菌株来源大肠埃希菌150株(北京市疾病预防控制中心保存)。2004年11月-2005年3月分离自北京市出生或在北京市生活10年~的健康志愿者粪便标本; 按分离时间顺序编号1~150。质控菌株为大肠埃希菌ATCC 25922(中国药品生物制品检定所)。
1.2 方法 1.2.1 大肠埃希菌鉴定和抗生素敏感性试验采用Vitek 32细菌分析仪(法国生物梅里埃公司)。结合GNI+革兰阴性菌鉴定卡和GNS-120革兰阴性菌药敏卡, 进行细菌鉴定和21种抗生素敏感性测定; 对链霉素、萘替米星、萘啶酸、四环素、氯霉素、磺胺甲基异噁唑(北京天坛药物生物技术开发公司)、甲氧苄啶(英国Oxiod公司)7种抗生素, 按美国国家临床实验室标准委员会(NCCLS)推荐的纸片扩散法进行药敏试验。结果根据NCCLS (2004年版)的标准进行判断。
1.2.2 PCR扩增检测Ⅰ类整合子煮沸法提取细菌总DNA, Ⅰ类整合子上游引物〔3〕:5′-GGCATCCAAGCAGCAAG-3′, 下游引物〔3〕:5′-AAGCAGACTTGACCTGA-3′序列。PCR反应在Gene Amp 9700 PCR热循环仪上进行, 反应体系为50 μL, 含5 μL模板, 10×buffer 5 μL, 2 mmol/L MgCl2, 0.2 mmol/L dNTPs, 200 pmol/L引物, 1.25 UTaq酶(Promega)。循环条件:预变性94℃ 5 min, 变性94℃ 40 s, 退火56℃ 30 s, 延伸72℃ 3 min, 最后延伸72℃ 7 min, 循环数31。产物经琼脂糖凝胶电泳分离, 溴化乙锭(EB)染色后, 应用UVI凝胶成像系统(英国Uviteh公司)观察结果。
1.2.3 可变区扩增产物酶切分析及测序扩增产物用Hinf I (G′ANTC)和Taq I (T′CGA)(美国NEB公司)进行限制性核酸内切酶分析(RFLP), 酶切反应体系和条件参照说明书。酶切图谱相同的扩增子含有相同基因盒, 用Qigen胶回收试剂盒纯化不同扩增子, 送上海博亚生物工程公司测序。测序结果用Blastn (Basic Local Alignment Search. Tool)在GenBank数据库中查找相似序列进行同源性检索。
1.2.4 脉冲场凝胶电泳分子分型(1) 制备染色体DNA:菌株接种于营养琼脂培养基, 37℃培养16~18h, 取适量菌苔, 用细胞悬浊液配制吸光度(A)为3.6~4.5的菌悬液。取400μL菌液于微量离心管(eppendor管)中, 37℃水浴5 min, 加20 μL蛋白酶K (0.5 mg/mL)和400 μL的1%SeakemGold琼脂糖:1%十二烷基硫酸钠(SDS), 将混合物加入模具, 室温凝固10~15 min。胶块放入含有5 mL细胞裂解液和25 μL蛋白酶K (0.1 mg/mL)的螺帽管内(screw-captube), 54℃水浴震荡2 h, 170r/min。用50℃预热纯水和三羟甲基氨基甲烷-乙二胺乙酸二钠(TE)洗涤胶块。(2) 酶切胶块内DNA:切下2 mm宽胶条, 在37℃ 200 μL缓冲稀释液(180 μL纯水, 20 μL酶缓冲液)中水浴15 min。放入含50U的Xba I限制性内切酶(美国NEB公司)内切酶的溶液中37℃水浴2 h。(3) 电泳:将酶切好的胶条置于模具上, 做成电泳胶块, 用Bio-Rad CHEF型脉冲场凝胶电泳仪进行电泳, 电泳参数为电压6.0 V/cm, 脉冲时间2.16~54.17s, 线性条件为转换角度120℃, 18h。
1.3 结果分析电泳结束后, 将胶块放入EB中染色, 用500 mL去离子水洗涤30~60 min, 在凝胶成像系统紫外灯下拍照。根据电泳图谱, 应用软件Fingerprinting Ⅱ对菌株进行同源性分析, 得到各菌株间相似性系数和同源分析树状图。
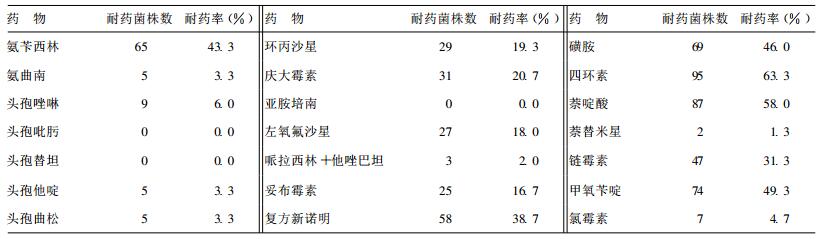
2 结果 2.1 大肠埃希菌药敏试验结果(表 1)| 表 1 健康人肠道大肠埃希菌耐药率(%) |
150株健康人群粪便大肠埃希菌中, 耐受 > 3种抗生素83株, 耐多药率达55.3%;检出超广谱β-内酰胺酶(ESBLs)阳性5株, 阳性率3.3%。其检出多见于临床分离菌株的ESBLs阳性株。150株健康人群粪便大肠埃希菌对亚胺培南、头孢替坦、头孢吡肟均100%敏感, 表明其面临的抗生素选择性压力可能低于临床分离菌株。
2.2 健康人大肠埃希菌Ⅰ类整合子携带情况(图 1)
|
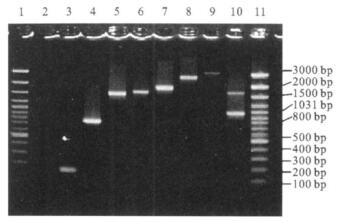
注:1, 11:Marker; 2:阴性对照; 3~10:分别为70, 97, 2, 60, 35, T19, 123, 120号大肠埃希菌菌株。 图 1 PCR扩增的Ⅰ类整合子的8种型别 |
2.2.1 Ⅰ类整合子分型
150株大肠埃希菌中, 检测到Ⅰ类整合子42株, 占28.0%, 可分出8种带型, 分别为150 bp 1株, 800 bp 1株, 1500 bp 8株, 1700 bp 27株, 1800 bp 2株, 2800 bp 1株, 3000 bp 1株以及1株(120号菌株, 图 1中第10泳道)含有2个大小不同的Ⅰ类整合子(1000和1700 bp)。
2.2.2 酶切预测序选择1500 bp (8株)、1700 bp (27株)、1800 bp (2株)整合子进行酶切分析。结果显示, 它们分别具有相同的酶切图谱, 表明这些大小相同的片段含有相同的DNA序列。整合子中基因盒测序结果显示, 150 bp (扩展编号M73819)为空整合子, 是转座子In39部分序列; 800 bp (扩展编号AY139596)整合子含基因盒dfr7;1500 bp (扩展编号AJ238350)整合子含基因盒dfr1-aadA1;1700 bp (扩展编号AY139591)整合子含基因盒dfr17-aadA5;1800 bp (扩展编号AF175203)整合子含基因盒dfr12-aadA2;2800 bp整合子除了含有基因盒dfr1-aadA1外, 还含有1个氨基糖苷类乙酰转移酶基因aacA4;3000 bp整合子测序失败, 但参考有关文献〔4〕该整合子可能含有基因盒aadB和cmLA; 具有2个整合子(1000, 1700 bp)的120号菌株所含的基因盒为aadA2(扩增编号AF071413)与dfr17-aadA5。
2.3 整合子与菌株耐多药及耐药表型关系耐受 > 6种抗生素52株, 其中37株含有整合子, 耐受 < 5种抗生素菌株未检出。携带耐药基因盒的菌株对相应抗生素表现出抗性, 携带aadA1、aadA2、aadA5的39株菌中, 25株对链霉素不敏感, 14株敏感; 携带dfr1、dfr7、dfr12及dfr17的39株细菌中, 38株对复方新诺明耐受, 1株对其敏感; 携带aacA4的1株菌对庆大霉素、妥布霉素、链霉素全部耐药。
2.4 脉冲场电泳结果PFGE图谱显示, 检测到Ⅰ类整合子的42株大肠埃希菌中, 能分型40株, 不能分型2株。应用软件对菌株进行同源分析, 相似系数 < 90%分成不同型别, 菌株145与96号系数为100%, 菌株T7和71号系数为90.3%。4株菌分别携带了一个相同大小的整合子, 但其流行病学资料无相关性, 为不同来源菌株。菌株174和30号的相似系数为86.7%, 整合子大小分别为1500和1700 bp。其余各菌株之间的相似系数均 < 85%, 确定为不同基因型。结果提示, 在相同或不同基因型菌株中均可含有相同的整合子。
3 讨论Ⅰ类整合子在临床和食源性致病菌中普遍流行〔5〕。本研究结果显示, 北京市健康人群粪便大肠埃希菌含有率达28.0%。耐药基因盒是整合子对抗生素表达抗性的关键所在〔6〕, 本研究中Ⅰ类整合子最常见带型是1700 bp, 占总数的64.3%, 基因盒dfr17-aadA5, 甲氧苄啶、链霉素、壮观霉素耐药。3种aadA耐药基因盒(aadA1、aadA2、aadA5), aadA是整合子可变区内存在频率最高的基因盒, 预防和控制动物性疾病中大量使用链霉素对aadA基因盒造成了强大的选择性压力, 促进了其发生和播散。甲氧苄啶和磺胺在临床上频繁使用。因此, 耐药基因盒drf在整合子内的携带率也较高〔7〕。
实验观察到细菌携带基因盒与其耐药表型有很好的对应关系, 整合子在介导细菌耐药性方面发挥着重要作用。对抗生素耐受的有些细菌没有检测到含相应耐药基因盒的Ⅰ类整合子, 这些菌株的抗性表达或许与其他DNA元件的插入有关, 其耐药基因可能位于其他类型整合子上〔5〕。
PFGE分型结果提示, 基因型相同的菌株和基因型不同的菌株都可含有相同的整合子, 不同的整合子也可存在于基因不相关菌株中, 这一现象表明整合子确实可以在细菌种内进行水平传播。为了减少整合子介导和传播细菌耐药性, 必须从临床、社区、畜牧养殖等多个环节合理使用抗生素, 减少抗生素的选择性压力。对细菌的耐药性研究应该从其产生的分子机制入手, 联合多种耐药机制, 通过基因调控等手段对其进行干预或控制。
| [1] | McDermott PF, Zhao S, Wangner DD, et al. The food safety per-spective of antibiotic resistance[J]. Animal biotechnology, 2002, 13(1) : 71–84. DOI:10.1081/ABIO-120005771 |
| [2] | 李咏梅, 李帆, 赵春燕. 肠出血性大肠埃希菌1类整合子与耐药性关系[J]. 中国公共卫生, 2005, 21(4) : 406–408. |
| [3] | Saenz Y, Brinas L, Domingues E, et al. Mechanisms of resistance in multiple-antibiotic-resislant Escherichia coli strains of human, animal, and food origins[J]. Antimicrobial Agents and Chemo-therapy, 2004, 48(10) : 3996–4001. DOI:10.1128/AAC.48.10.3996-4001.2004 |
| [4] | Wenzel RP, Edmond MB. Managing antibiotic resistance[J]. N Engl J Med, 2000, 343 : 1961–1963. DOI:10.1056/NEJM200012283432610 |
| [5] | Kang SG, Lee DY, Shin SJ, et al. Changes in patterns of antimicro-bial susceptibility and class 1 integron carriage among Escherichia coli isolates[J]. Journal of Veterinary Science, 2005, 6(3) : 201–205. |
| [6] | Fluit AC, Schmitz FJ. Resistance and integrons and super-integrons[J]. Clinical Microbiology and Infection, 2004, 10(4) : 272–28B. DOI:10.1111/j.1198-743X.2004.00858.x |
| [7] | Singh R, Schroeder CM, Meng J, et al. Identification of antimicrobi-al resistance and class 1 integrons in Shiga toxin-producing Esche-richia coli recovered from humans and food animals[J]. J Anti-microb Chemoiher, 2005, 56(1) : 216–219. DOI:10.1093/jac/dki161 |
 2009, Vol. 25
2009, Vol. 25