2. 广西医科大学公共卫生学院;
3. 广西医科大学第一附属医院
氢醌(hydroquinone, HQ)是苯的代谢产物, 在体内可引起急性白血病、血小板减少症、再生障碍性贫血等血液系统疾病, 因此, 造血系统细胞是氢醌的主要靶细胞。前期研究发现, 氢醌可在细胞存活水平诱导人胚肺成纤维细胞(MRC-5)产生适应性反应, 即细胞受到低剂量氢醌预刺激后, 可耐受后续高剂量的攻击。在MRC-5耐受与适应模型的研究中, 本研究利用蛋白质组学技术鉴定了与氢醌诱导MRC-5细胞适应性反应相关的蛋白〔1〕, 包括巯氧还蛋白过氧化物酶(Prxs)和热休克蛋白10(HSP10)家庭成员, 其中含2个半胱氨酸活性位点的2-CysPrxs (包括Prx1-4)和SHP10特别令人关注。研究表明, NAD (P) H:醌氧化还原酶(NQO1)具有保护苯致血液系统毒性的作用, 氢醌可诱导骨髓CD34+细胞NQO1表达, 减轻氢醌所致的细胞毒性及细胞凋亡〔2〕。本研究检测氢醌刺激脐血单个核细胞(umbilical cord blood mononuclear cells, UCBMC)诱导适应性反应, 并探讨NQO1、HSP10及2-Cys Prxs在其中作用。
1 材料与方法 1.1 标本新鲜脐血取自广西医科大学第一附属医院健康足月产新生儿脐带血, 无菌采集, 枸橼酸钠抗凝。
1.2 主要试剂杜尔贝克(IMDM)培养基(美国Hyclone公司); 羟基淀粉、梯度细胞分离液(Ficoll-Paque)、无血清液体培养基(StemspanTM SFEM, 加拿大Stemcell公司); Annexin V-FITC凋亡检测试剂盒(深圳晶美生物公司); cDNA合成试剂盒PCR试剂盒与荧光定量PCR引物(沈阳TakaRa公司); Tr-izol (美国Invitrogen公司)。其余试剂为国产分析纯。
1.3 UCBMC分离培养取脐血, 5:1加入羟基淀粉, 室温静置30~40min, 收集上清及有核细胞层, 用含2%胎牛血清(FBS)的磷酸盐缓冲液(PBS)清洗细胞, 重悬, 按1:1比例加入Ficoll-Paque中, 室温400g离心30min, 去除上层液体, 取单个核细胞层, 2% IMDM清洗, StemspanTM SFEM重悬。
1.4 UCBMC细胞染毒方案根据HQ刺激MRC-5细胞产生适应性反应的剂量〔1〕, 分对照组, 低剂量组、适应性反应组和高剂量组, 每组5孔/管, 各组细胞数为2×106个/mL。选择预刺激的低剂量为10μmol/L, 作用时间12h;高剂量250μmol/L, 作用时间5 h。
1.5 细胞凋亡检测UCBMC离心, 弃上清, PBS重悬, 调节细胞浓度至1×106个/mL, 分别加入5 μL磷脂蛋白荥光素(Annexin V-FITC)和/或10 μL溴化丙啶(PI), 避光15min, 每管加入400 μLPBS、1 h内上机检测。
1.6 荧光定量PCR 1.6.1 总RNA制备取各实验组UCBMC, 弃培养液, 加入1 mL Trizol, 室温放置10 min, 加0.2 mL氯仿, 振荡15 s, 静置3 min, 4℃, 12000 g离心15 min, 取水相加入0.5 mL异丙醇, 室温放置10 min, 4℃, 12000 g离心10 min, 75%乙醇洗涤干燥后溶于纯焦碳酸二乙酯(DEPC)处理水, 紫外分光光度仪检测提取总RNA质量和浓度。要求A260/A280在1.8~2.1范围, 并计算RNA含量。
1.6.2 cDNA的合成反应体系20 μL, 取随机引物(100 μmol/L) 1 μL, 每一标本取总RNA 1 μL, RNA酶抑制剂(40 U/μL) 0.5 μL, dNTP混合物(各10 μmol/L) 1 μL, 5倍反应缓冲液4 μL, 逆转录酶100 U, 加DEPC水至20 μL。按42 ℃ 30 min, 95 ℃ 2 min, 进行逆转录。合成好的cDNA置于-20℃保存备用。
1.6.3 实时定量PCR25 μL反应体系中包括:上下游引物(10 μmol/L)各0.4 μL, 2倍混合液12.5 μL (包括反应缓冲液、dNTP、MgC12、SYBRGreenI、Taq酶), 双蒸水10.7 μL, cDNA标本1 μL。各基因扩增片段长度如下:HSP10为143bp, NQO1为107bp, Prx1为141bp, Prx2为129bp, Prx3为98bp, Prx4为75bp。以β-actin基因为内参, 相对表达量的计算公式为:ΔΔCT=ΔCT待测基因-ΔCT内参基因, 平均相对含量=2-平均ΔΔCT。
1.7 统计分析采用SPSS11.0软件进行单因素方差分析。
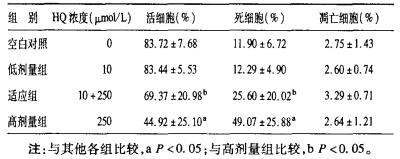
2 结果 2.1 HQ刺激UCBMC流式分析结果(表 1)| 表 1 HQ刺激UCBMC流式分析结果(n=5。x±s) |
结果显示, UCBMC受到10 μmol/L氢醌预刺激12 h后再给予250 μmol/L氢醌刺激, 与单独使用250 μmol/L大剂量氢醌刺激的细胞比较, Annexin V-/PI-细胞百分比升高, Annexin V+/PI+细胞百分比降低, 出现适应性反应。
2.2 HQ刺激UCBMC适应性反应中基因表达(表 2)| 表 2 HSP10、NQO1、Prxl-4基因在UCBMC的表达(x±s) |
总RNA凝胶电泳后, 28 s亮度明显强于18 s, 5 s很弱, 说明RNA完整性较好, 分光光度计测A260/A280在1.8~2.1。各目的基因在UCBMC表达相对定量检测结果显示, NQO1、Hsp10、Prx1~4各引物融解曲线均呈清晰的单一峰型, 各基因表达Ct值在16~25。各基因的相对表达量在0.8~4, 与空白对照组比较, 高剂量组HSP10、Prx3、Prx4表达明显增高, 适应组Prx1明显增高。NQO1在高剂量组和适应组表达均较空白对照组明显增高, 且与适应组比较有明显差别。
3 讨论机体在受到低水平环境因子刺激后, 可能诱导产生一系列保护性反应, 从而产生适应现象。氢醌是一种潜在的氧化剂, 氧化损伤是氢醌的主要毒作用机制之一。研究表明, 氢醌可降低细胞内谷胱甘肽和蛋白巯基水平, 升高细胞内活性氧, 改变细胞内氧化还原状态而对细胞造成损伤〔3-4〕。细胞受到低于损伤剂量氢醌刺激时, 可能激活一些氧化应激相关的蛋白, 使细胞对后续强烈的氧化刺激产生耐受和适应反应。本研究结果显示, 与空白对照组比较, HSP10及2-CysPrxs表达在低剂量组均未见明显差异, 但在高剂量组或适应组表达增高, 提示这些基因的表达参与了HQ诱导的适应性反应, 但并非处于适应性反应机制的上游阶段。NQO1在适应组及高剂量组均持续表达增高, 提示NQO1主要参与HQ的细胞毒性反应, NQO1高表达有利于保护细胞免于死亡。Prxs是一类抗氧化蛋白, 可抑制金属催化的酶氧化反应, 保护细胞免受氧自由基损害, 不同的Prxs成员在抗氧化中的功能及激活途径等各有不同。本研究结果也显示, 各Prxs在HQ诱导的脐血单个细胞适应性反应中表达不尽相同, 其中Prxs4表达在适应组和高剂量组间差异有统计学意义, 提示Prxs4在其中起重要作用。
| [1] | Li X, Tang S, Huang H, et al. Induction of a cell-survival adaptive response in MRC-5cells by hydroquinone[J]. Mutat Res, 2008, 652(2) : 180–185. DOI:10.1016/j.mrgentox.2008.02.006 |
| [2] | Moran JL, Siegel D. A potential mechanism underlying the in-creased susceptibility of indiveduals with a polymorphism in NAD (P) H :quinone oxidoreductase (NQOl) to benzene toxicity[J]. Proc Natl Acad Sci U S A, 1999, 96(14) : 8150–8155. DOI:10.1073/pnas.96.14.8150 |
| [3] | Shen DX, Shi X, Fu JL, et al. The role of thiol reduction in hydre-quinone-induced apoptosis in HEK293 cells[J]. Chem Biol Inter-act, 2003, 145(2) : 225–334. DOI:10.1016/S0009-2797(03)00003-6 |
| [4] | 申东晓, 史须, 王应, 等. 硫氧还蛋白对氢醌细胞毒性的抑制[J]. 中国药理学与毒理学杂志, 2003, 17(1) : 55–6032. |
 2009, Vol. 25
2009, Vol. 25

 , 陆彩玲2, 曾晓春3, 肖德强2, 孙斌2, 郭松超2
, 陆彩玲2, 曾晓春3, 肖德强2, 孙斌2, 郭松超2