2. 南昌大学中德联合研究院
黄曲霉毒素是某些黄曲霉和寄生曲霉产生的一种肝毒素, 对动物有极强的毒性和致癌性。其毒性比已知的致癌物质二甲基亚硝酸的毒性高75倍。黄曲霉毒素能引起试验动物致癌已成定论〔1〕。分子遗传学分析表明, 黄曲霉与寄生曲霉毒素生物合成涉及25个相关结构基因〔2〕。研究表明, 这些基因的表达与毒素的产生密切相关〔3〕。本实验采用诱导产毒的培养方法培养寄生曲霉AS3.4407, 利用基因芯片技术研究寄生曲霉AS3.4407产毒后2种菌丝体中与产毒相关基因的表达情况, 探讨产毒相关的部分基因的表达与产黄曲霉毒素之间的关系。
1 材料与方法 1.1 材料寄生曲霉(Aspergillus parasiticus) AS3.4407(中国利学院微生物菌种保藏中心)。N-Phenazine methosulfate (PMS)液体培养基, 二次液体培养基。上述培养基均于110℃, 70 kPa灭菌20 min后备用。氯化钠、柠檬酸钠、荧光标记逆转录-聚合酶链反应(RT-PCR)(上海生工生物工程技术服务有限公司); DNA酶I (DNaseI, 大连宝生物公司)。
1.2 方法(1)差异表达菌丝体的获得:将寄生曲霉AS3.4407孢子分别接种于等体积的2瓶250 mLPMS液体培养基中, 接种量为107个孢子/mL, 于28℃, 200 r/min摇床培养3 d, 收获寄生曲霉AS3.4407的菌丝体。其中1瓶作为不产黄霉毒素的研究材料; 同时将另1瓶寄生曲霉的菌丝体转入250 mL新鲜的二次液体培养基中, 于28℃, 200 r/min培养42 h, 然后收获寄生曲霉AS3.4407的菌丝体作为高产黄曲霉毒素的研究材料。抽真空过滤寄生曲霉培养物; 菌丝体用磷酸盐缓冲液(PBS)洗涤3次后备用。(2)总RNA的提取与鉴定、DNaseI处理、荧光标记RT-PCR反应、芯片杂交及图像采集参照文献〔4-6〕。
2 结果 2.1 总RNA的提取与鉴定(图 1)
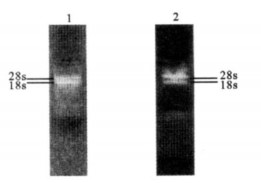
|
注:1:寄生曲霉总RNA-1;2:寄生曲霉总RNA-2。 图 1 寄生曲霉总RNA甲醛变性凝胶电泳图 |
从寄生曲霉AS3.4407产毒和不产毒2种菌丝中提取得到的RNA清晰可见, 分别标记为RNA-1和RNA-2, 均有2条沉降系数分别为28和18s的RNA条带。通过RT-PCR从寄生曲霉RNA-1中获得25个与黄曲霉毒素生物合成相关的基因片段和1个阳性对照β -tublin基因片段; 从寄生曲霉RNA-2中获得与黄曲霉毒素生物合成相关的19个基因片段和1个阳性对照β-tublin基因片段, 其余6个基因片段未能通过扩增获得。LacZ基因片段均来源于大肠埃希菌DH5α。与芯片杂交前荧光标记好的样品必须经过纯化, 以防止杂质污染降低芯片检测的可靠性。
2.2 芯片扫描图像芯片上每个基因点阵重复2次, A1-A5分别为aflA、aflB、aflC、aflD、aflE; B1-B5分别为aflF、aflG、aflH、aflI、aflJ; C1-C5分别为aflK、aflL、aflM、aflN、aflO; D1-D5分别为aflP、aflQ、aflR、aflS、aflT; E1-E5分别为aflU、aflV、aflW、aflX、aflY; F1为阳性对照β-tublin基因片段; F2为阴性对照LacZ基因片段; F3为空白对照3 ×氯化钠-柠檬酸钠缓冲液(standard saline citrate, SSC)。每个基因的荧光信号稳定, 荧光背景低, 无杂信号干扰。来源于产毒菌丝样品的芯片扫描结果表明, 与产毒相关的25个基因以及1个阳性对照基因β-tublin都显示出稳定的荧光信号, 阳性对照点无荧光信号。这与产毒菌丝RT-PCR的结果一致。而来源于非产毒菌丝样品的芯片扫描结果则显示只有19个与黄曲霉素生物合成相关的基因和1个阳性对照β-tublin基因有稳定的荧光信号, 其余6个基因(aflA、aflE、aflF、aflR、aflT和aflX)和2个阴性对照组点无荧光信号, 与不产毒菌丝反转录PCR的结果一致。空白对照组无荧光信号。结果表明, 产毒与不产毒菌丝中与毒性相关的部分基因存在差异表达。芯片扫描的结果与RT-PCR的扩增结果一致, 匀显示有6个基因(aflA、aflE、aflF、aflR、aflT和aflX)存在表达差异。
3 讨论寄生曲霉总RNA的完整性和纯度都是试验顺利进行的前提。提取真菌总RNA的方法很多, 淡明等采用的RNA提取法, 虽简单但完整性和纯度均欠佳〔7〕。本研究采用液氮研磨法提取的总RNA质量好, 可以满足试验需要, 直接将与黄霉毒素生物合成相关的25个基因片段点阵于玻片上, 通过此芯片检测寄生曲霉AS3.4407中与产毒相关的基因是否表达, 筛选出寄生曲霉AS3.4407产毒与非产毒菌丝体之间与产毒相关的差异表达基因。筛选结果可靠, 该方法可直接用于检测霉菌中所有产毒相关基因表达与否, 快速筛选与产毒相关的差异表达基因。研究发现, 黄曲霉毒素生物合成途径涉及25个基因。其中大部分是编码蛋白酶的结构基因, 少数为调节基因〔8-9〕。有研究报道显示, 用PCR法扩增发现, 不产黄曲霉毒素的酱油曲霉中存在与产毒基因同源的序列, 其不产毒机制尚待进一步研究〔10〕。还有研究者用生物芯片技术寻找到25个产毒基因以外的其他可能与产毒相关基因〔11-12〕, 但未进一步确证其功能。本研究从分子水平上分析了寄生曲霉毒素的机制, 为进一步探讨黄曲霉毒素生物合成路线关键基因的作用提供了基础依据。
| [1] | 胡娜, 许杨. 黄曲霉毒素污染控制技术研究进展[J]. 中国公共卫生, 2006, 22(3) : 371–373. |
| [2] | Woloshuk CP, Prieto R. Genetic organization and function of the af2 latoxin B1 biosynthetic genes[J]. FEMS Microbiol Lett, 1998(160) : 169–176. |
| [3] | Georgianna DR, Payne GA. Genetic regulation of aflatoxin biosyn2 thesis: from gene to genome[J]. Fungal Genetics and Biology, 2009(6) : 113–125. |
| [4] | 汤祖辉, 赖卫华, 许杨. 红曲霉RNA的提取方法[J]. 江西科学, 2002, 20(2) : 118–120. |
| [5] | 胡娜, 许杨, 涂追. 黄曲霉pksA基因部分序列的同源性分析[J]. 江西农业大学学报, 2007, 29(1) : 134–138. |
| [6] | |
| [7] | 淡明, 黄海波, 郭安平, 等. 一种简单高效的真菌意RNA提取方法[J]. 福建热作科技, 2006, 31(4) : 21–22. |
| [8] | Yu J, Bhatnagar D, Cleveland TE. Comp leted sequence of afatoxin pathway gene cluster in Aspergillus parasiticus[J]. FEBS Letters, 2004, 564(2) : 126–130. |
| [9] | Yabe K, Nakajima H. Enzyme reacions and genes in aflatoxin biosyn2 thesis[J]. App lMicrobiol Biotechnol, 2004(64) : 745–755. |
| [10] | Minto RE, Townsend CA. Enzymology and molecular biology of af2 latoxin biosynthesis[J]. Chem Rev, 1997(979) : 2537–2556. |
| [11] | Tominaga M, Lee YH, Hayashi R, et al. Molecular analysis of an inactive aflatoxin biosynthesis gene cluster in Aspergillus oryzae R IB strains[J]. App l EnvironMicrobiol, 2006(72) : 484–490. |
| [12] | Brian GR, Fakhoury AM, Payne GA. Identification of genes differ2 entially exp ressed during aflatoxin biosynesis in Aspergillus flavus and Aspergillus parasiticus[J]. Fungal Genetics and Biology, 2003(39) : 118–127. |
 2009, Vol. 25
2009, Vol. 25

