2. 河北医科大学基础医学院病理教研室
乙醇是一种确认致畸物, 母亲孕期大量饮酒可致胎儿酒精综合征〔1〕, 男性酗酒可使性功能减退并引起后代发育和行为异常〔2〕。为提高人类生命质量和优生优育, 研究乙醇的生殖遗传毒性具有重要意义。本研究通过经口灌胃给予雄性大鼠乙醇, 建立慢性乙醇中毒模型, 观察乙醇对睾丸形态和功能的影响, 同时观察锌对其睾丸毒性的拮抗作用, 并研究其可能的作用机制, 为防止酒精中毒及其所致的生殖毒性探讨有效的阻断途径。
1 材料与方法 1.1 材料 1.1.1 主要仪器与试剂H-7500型透射电镜、RP20型高速冷冻离心机(日本HITACHI公司); FT-646A型微机单头放免仪(北京核仪器厂); 生物显微镜及其摄影系统(日本OLYMPUS公司); HPIAS 1000型全自动图像分析系统(同济大学医学院病理教研室千屏公司); 转移电泳仪(北京六一仪器厂); 凝胶成像分析仪(美国UVP公司)。无水乙醇(分析纯, 石家庄有机化工厂); 葡萄糖酸锌(石家庄神威药业有限公司); 睾酮放免试剂盒(中国原子能科学院同位素研究所); 丙二醛(MDA)测定试剂盒(南京建成生物研究所); 诱导型一氧化氮合酶(iNOS)免疫组化试剂盒(北京中山生物技术公司)。
1.1.2 实验动物30只健康性成熟雄性SD大鼠(河北省实验动物中心), 体重180~220 g。
1.2 方法 1.2.1 动物分组及处理30只SD大鼠随机分为3组:对照组、乙醇组(7.5 g/kg乙醇)、乙醇+葡萄糖酸锌组(7.5 g/kg乙醇+7.7 mg/kg葡萄糖酸锌), 每组10只。每日上午灌胃给予乙醇, 灌胃体积为1.5 mL/100g, 对照组给予等量蒸馏水; 下午灌胃给予葡萄糖酸锌, 连续13周。末次染毒24 h后采血, 处死动物, 取双侧睾丸, 称重。一侧待做睾丸线粒体丙二醛(MDA)含量测定及蛋白印迹(Western-blot)检测; 另一侧用于光镜、电镜的形态学观察及免疫组织化学染色; 将一侧输精管内精液挤出并剪碎附睾尾, 加入1mL精子营养液〔3〕, 混匀即成精子悬液, 进行精子计数、精子活动率、精子畸形率测定。
1.2.2 精子计数、精子活动率、精子畸形率测定参照文献〔4〕操作。
1.2.3 睾丸形态学观察常规制备苏木素-伊红染色(HE)切片和超薄切片, 分别于光学显微镜及透射电子显微镜下观察。
1.2.4 血清睾酮测定采用放射免疫法。
1.2.5 睾丸线粒体MDA含量测定取一侧睾丸, 摘除被膜后, 加入6倍体积的含0.25 mmol/L蔗糖、1 mmol/L氯化镁、10 mmol/LTris-HCl缓冲液(pH=7.4), 在冰浴下制成匀浆, 4℃ 600 g离心, 得上清液, 再以9700 g离心30 min, 得沉淀用0.15 mol/L氯化钾、0.15 mol/L磷酸钾缓冲液(pH 7.4)冲洗, 再以9700 g离心30 min, 最后得睾丸线粒体悬液。MDA的测定严格按操作说明书进行, 悬液中蛋白含量测定采用考马斯亮蓝法。
1.2.6 免疫组织化学染色用4%的多聚甲醛溶液固定睾丸组织, 石蜡包埋、切片后以链酶亲和素-过氧化物酶(SABC)法进行免疫组织化学染色。切片经1%甲醇-过氧化氢处理, 血清封闭, 加入iNOS (1:50)抗体于4 ℃冰箱过夜, 再加入生物素标记的二抗, 37 ℃处理30 min, 加入辣根过氧化物酶标记的链霉卵白素孵育, 经二氨基联苯胺(DAB)显色, 苏木素复染, 干燥、脱水、透明、中性树胶封片, 光镜观察。免疫组化图像分析经标准灰度校正后随机取5个视野, 在同等条件下测定iNOS的平均积分吸光度(A)值(平均总积分减去平均背景积分)。
1.2.7 睾丸组织中iNOS含量的Western-blot法检测取睾丸组织约100mg加入裂解液100 μL提取蛋白, 用考马斯亮蓝法测定蛋白浓度(mg/mL), -80 ℃保存。每个样品取50 μg总蛋白, 8%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后电转移至聚偏二氟乙烯(PVDF)膜, 5%脱脂奶粉37 ℃封闭, 再加入兔抗鼠iNOS单克隆抗体1:200稀释, 4 ℃过夜。采用增强化学发光(ECL)法显色, Lab Works 4.5软件(美国UVP公司)对条带进行定量分析, 确定杂交条带的相对密度值。
1.3 统计分析应用SPSS 10.0统计软件进行分析, 均数间的两两比较采用Dunnett-t检验。
2 结果 2.1 各组大鼠精子计数、精子活动率、精子畸形率情况(表 1)| 表 1 各组大鼠精子数、精子活动率、精子畸形率(n=10,x±s) |
表 1可见, 乙醇组与对照组比较, 精子计数减少78%(P < 0.05), 精子活动率下降71%(P < 0.05);乙醇引起的精子形态改变有:头部畸形如无头、小头、巨头、双头等; 尾部卷曲、无尾或双尾等, 乙醇组精子畸形率与对照组比较明显升高(P < 0.05)。乙醇+葡萄糖酸锌组补充葡萄糖酸锌后, 精子计数、精子活动率较乙醇组明显上升(P < 0.05), 但仍明显低于对照组(P < 0.05);精子畸形率虽有所下降, 但与乙醇组比较差异无统计学意义。
2.2 睾丸的组织病理学观察光镜下对照组睾丸生精上皮细胞形态正常。乙醇组睾丸的曲细精管有不同程度的损伤, 表现为某些生精细胞核固缩、变性, 精子细胞变态期核固缩, 曲细精管腔中脱落细胞增多。乙醇+葡萄糖酸锌组睾丸损伤程度明显轻于乙醇组, 表现为大部分曲细精管结构正常, 核固缩、变性的生精细胞数目明显减少。
电镜观察睾丸的超微结构:对照组基膜及形态正常; 乙醇组大鼠生精上皮超微结构显示, 各级生精细胞和支持细胞均有损伤, 包括支持细胞内溶酶体增多, 支持细胞滑面内质网变性退化; 精原细胞核空泡化; 初级精母细胞核变性溶解; 精子细胞变态期核溶解, 局部核内陷, 核周隙扩大; 变态期精子细胞移至基膜处, 表明生精上皮紊乱。乙醇+葡萄糖酸锌组动物睾丸损伤程度明显轻于乙醇组, 大部分曲细精管结构正常, 超微结构下精子细胞、精子顶体形成期均正常。
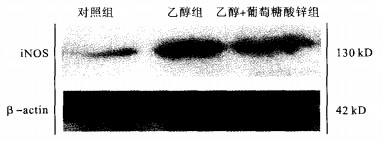
2.3 乙醇对睾酮、睾丸线粒体MDA及iNOS表达的影响(表 2, 图 1) 表 2可见, 乙醇组血清睾酮水平较对照组明显降低(P < 0.05);乙醇+葡萄糖酸锌组血清睾酮水平仍明显低于对照组(P < 0.05), 与乙醇组比较则无明显差别; 乙醇组睾丸线粒体MDA产生量明显高于对照组(P < 0.05);乙醇+葡萄糖酸锌组睾丸线粒体MDA产生量较乙醇组明显降低(P < 0.05), 但仍较对照组高(P < 0.05)。结果显示, 对照组仅有少量的iNOS表达; 与对照组比较, 乙醇组iNOS表达量均明显增加(P < 0.01);与乙醇组比较, 乙醇+葡萄糖酸锌组iNOS的表达明显降低(P < 0.05), 但仍较对照组高(P < 0.05)。
| 表 2 乙醇对大鼠睾酮、睾丸线粒体MDA及iNOS表达的影响(n=10, x±s) |
|
图 1 各组大鼠睾丸内iNOS表达的Western-blot检测 |
3 讨论
本实验结果表明, 给予实验动物乙醇13周使其精子数量减少, 精子活动率下降, 精子畸形增多, 生精细胞退化变性, 同时还抑制睾丸间质细胞合成睾酮, 与文献〔5-7〕报道一致。体内NO主要是由NO合酶(NOS)催化左旋精氨酸产生, 诱导型(iNOS)是NOS中的一种, 其在正常组织内表达较弱, 仅在细胞受到刺激时表达明显增强, 产生大量NO及超氧阴离子。过量NO与超氧阴离子反应生成具更强氧化性的过氧硝基阴离子, 作用于酶、蛋白质、脂质及DNA等大分子物质, 产生细胞毒作用, 导致细胞损伤或死亡〔8〕; 而睾丸线粒体膜、精子均富含不饱和脂肪酸, 易受过氧化攻击, 从而严重影响睾丸生精功能及精子生活的内环境。本研究显示, 接受乙醇处理的大鼠生精细胞iNOS表达增强, 睾丸线粒体丙二醛产生增多, 同时睾丸发生明显的组织学改变, 提示过量NO引起的氧化损伤可能是乙醇致睾丸损伤的重要作用机制之一。锌是机体必需的微量元素与生殖系统的发育、功能密切相关, 适量锌可对抗自由基等多种因素诱发的睾丸生精细胞凋亡〔9〕。乙醇+葡萄糖酸锌组精子计数、精子活动率明显升高, 曲细精管受损程度减轻, 睾丸iNOS表达减弱, 线粒体丙二醛产生减少。表明给乙醇喂养的动物补充锌抑制了乙醇所致睾丸的过氧化损伤, 生精细胞退化变性程度减轻, 在一定程度上保护了睾丸的生精功能, 保持了生精细胞的成熟。
| [1] | Abel EL. Fetal alcohol syndrome: a cautionary note[J]. Curr PHarmDes, 2006, 12(12) : 1521–1529. DOI:10.2174/138161206776389886 |
| [2] | Emanuele MA, Emanuele N. Alcohol and the male reproductive system[J]. Alcohol Res Health, 2001, 25 : 282–287. |
| [3] | 佟慕光. 不孕与不育[M]. 上海: 上海科学技术出版社, 1984: 156. |
| [4] | 马青年. 实用男性学[M]. 天津: 天津科学技术出版社, 1987: 53. |
| [5] | 赵永久, 陈昭典, 任福金, 等. 酒精对雄性大鼠生殖内分泌的影响[J]. 中华男科学杂志, 2005, 11(12) : 951–953. |
| [6] | Maneesh M, Jayalekshmi H, Dutta S, et al. Effect of chronic ethanol administration on testicular antioxidant system and steroidogenic enzyme activity in rats[J]. Indian J Exp Biol, 2005, 43(5) : 445–449. |
| [7] | 解丽君, 赵松, 胡文媛. 酒精对雄性大鼠生精功能和生殖激素的影响[J]. 中国公共卫生, 2004, 20(3) : 280–281. |
| [8] | 逄丹, 梁惠, 贺娟, 等. 海藻萜类化合物对酒精暴露大鼠抗氧化作用[J]. 中国公共卫生, 2008, 24(4) : 464–466. |
| [9] | Summers BL, Henry CM, Rofe AM, et al. Dietary zinc supplementation during pregnancy prevents spatial and object recognition memory impairments caused by early prenatal ethanol exposure[J]. Behav Brain Res, 2008, 186(2) : 230–238. DOI:10.1016/j.bbr.2007.08.011 |
 2009, Vol. 25
2009, Vol. 25


