2. 遵义医学院预防医学教研室
近年来, 氟中毒发病过程中发生自由基代谢紊乱和氧化应激反应成为研究热点〔1〕。但多数研究建立在用不同剂量的氟化钠喂饲大鼠3个月以上, 本实验通过不同浓度氟喂饲大鼠1个月后, 观察氟对大鼠肝脏超微结构的影响; 并检测大鼠肝组织的自由基含量及氧化应激相关指标, 探讨后两者之间在氟中毒发病过程中的变化, 以及这些反应发生的时间、条件, 是否存在摄氟的剂量-效应关系, 为揭示氟中毒的发病机制及治疗提供科学依据。
1 材料与方法 1.1 实验动物分组及处理清洁级3周龄SD大鼠32只(中国人民解放军第三军医大学第三附属医院)。根据大鼠体重随机分为4组, 每组8只, 雌雄各半, 在本院实验动物室饲养。对照组大鼠每天定时以去离子水灌胃, 实验组大鼠每天定时分别给予含NaF (分析纯) 10, 20, 40 mg/kg的去离子水灌胃。分别于1个月后处死, (1)采集血液标本:置于具塞聚乙烯管中, 立即离心6 000 r/min, 10 min, 取血清, 保存于-35 ℃冰柜中, 待测血氟浓度。(2)肝脏组织制备:制成10%的组织匀浆, 分别保存于-35 ℃及-80 ℃冰柜中, 待测一氧化氮(NO)、丙二醛(MDA)含量及谷胱甘肽过氧化物酶(GSH-Px)活性。(3)透射电镜标本制备:取1 mm×1 mm×1 mm新鲜肝脏组织于冰冷的2. 5%戊二醛中固定, 以1%四氧化锇再固定, 逐级乙醇、丙酮脱水, Epon-812包埋, LKB2V型超薄切片机切片, 醋酸铅和柠檬酸铅双染, 在透射电子显微镜下观察超微结构变化并照相。
1.2 方法参照《血清中氟化物的测定-离子选择电极法标准(WS/T212-2001) 》检测血氟浓度。NO采用硝酸还原酶法检测, MDA采用硫代巴比妥酸(TAB)法检测, GSH-Px活性采用二硫代二硝基苯甲酸法检测。检测试剂盒(南京建成生物工程研究所)。
1.3 统计分析采用SPSS10.0软件进行方差分析。
2 结果 2.1 各组大鼠血氟、肝脏NO、MDA含量及GSH-Px活性变化(表 1)| 表 1 各组大鼠血氟、肝脏NO、MDA含量及GSH-Px活性(x±s, n=8) |
随染氟剂量的增加, 1个月后各剂量组大鼠血氟浓度相应增加, 存在剂量-效应关系(R=0. 884, P < 0. 01)但各剂量组间血氟浓度差异无统计学意义; NO含量与对照组比较差异无统计学意义(P > 0. 05), 但存在剂量-效应关系(R=0. 361, P < 0. 05); MDA含量升高, 与对照组比较差异有统计学意义(P < 0. 01), 存在剂量-效应关系(R=0.797, P < 0.01); GSH-Px的活性下降, 与对照组比较差异有统计学意义(P < 0.01), 存在剂量-效应关系(R=-0.912, P < 0.01)。
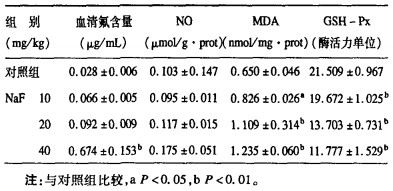
2.2 各组大鼠肝细胞超微结构(图 1)
|
图 1 对照组肝细胞超微结构(TEM, 8 000 ×) |
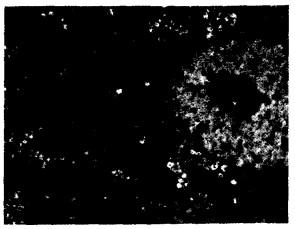
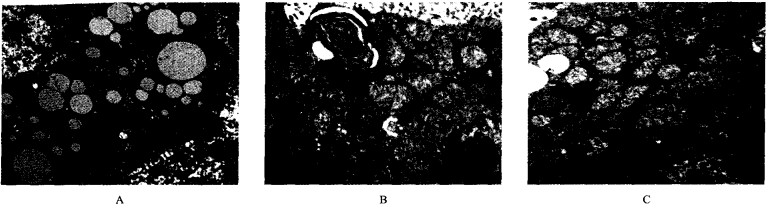
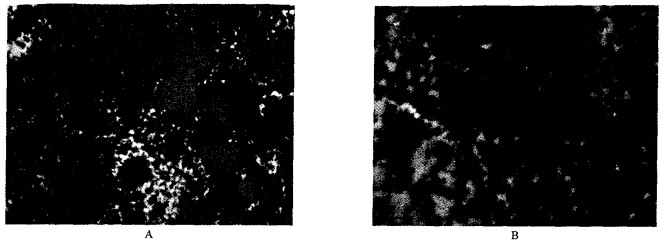
对照组肝细胞线粒体核糖体丰富, NaF低剂量组(图 2)肝细胞线粒体核糖体较多, 线粒体肿胀不明显; NaF中剂量组(图 3A、B、C)肝细胞线粒体肿胀, 有较多脂肪变性; NaF高剂量组(图 4A、B)肝细胞线粒体肿胀明显, 有较多脂肪变性。

|
图 2 10 mg/kg NaF组肝细胞超微结构(TEM, 8 000 ×) |
|
图 3 20 mg/kg NaF组肝细胞超微结构(TEM, 8 000 ×) |
|
图 4 40 mg/kg NaF组肝细胞超微结构(TEM, 8 000 ×) |
3 讨论
NO作为一种生物活性递质和自由基, 在氟中毒的发病过程中可能起着重要的作用。NO若生成过多, 易攻击细胞的生物膜, 使某些氨基酸残基发生突变, 蛋白多肽链也会随之断裂、聚合或交联, 发生脂质过氧化作用, 导致蛋白结构和功能的改变, 进而导致胞膜的正常结构和功能被破坏〔2〕。李术〔3〕等研究发现, 奶山羊染氟1年后, 肝组织中NO含量显著高于对照组。本实验发现, 在氟中毒早期, 肝组织中NO的含量检测并不敏感; 但MDA含量及GSH-Px活性改变, 可作为氟中毒早期较敏感的参考指标。各染氟组大鼠肝脏中MDA含量增多, 而MDA是脂质过氧化反应的产物, 因此, 间接证明了氟诱导脂质过氧化反应的增强, 该结果与众多实验研究〔4-6〕一致。各染氟组大鼠肝脏中GSH-Px活性下降, 表明氟可诱导大鼠体内抗氧化系统异常, 与氟中毒在动物及人体内引起氧化应激反应的报道〔7-10〕一致。本实验中, 10 mg/kg的NaF就引起了肝组织中MDA的含量及GSH-Px活性改变, 但肝细胞的超微结构未受影响, 证实了MDA含量及GSH-Px活性改变是较敏感的指标; 而20, 40 mg/kg NaF剂量组中, 肝细胞的超微结构发生改变。这是由于过量氟可抑制体内抗氧化酶的活性, 不能及时清除自由基。过量的自由基能通过脂质过氧化产物MDA交联蛋白质和磷脂的氨基, 改变生物膜的流动性和稳定性, 破坏生物膜的完整性, 导致细胞的变性、坏死。但随着染氟时间的延长, 肝脏内NO含量的改变, 以及是否存在剂量-效应关系, 还有待进一步研究。
| [1] | 李广生, 徐辉. 再谈慢性氟中毒与氧化应激[J]. 中国地方病学杂志, 2005, 24(1) : 3–4. |
| [2] | Sargis RM, Subbaiah PV. Protection of membrane cholesterol by sphingomyelin against free radical-mediated oxidation[J]. Free Radic Biol Med, 2006, 40(12) : 2092–2102. DOI:10.1016/j.freeradbiomed.2006.02.005 |
| [3] | 李术, 徐世文, 孙刚, 等. 氟对奶山羊体内自由基和脂质代谢的影响[J]. 中国地方病学杂志, 2003, 22(3) : 201–203. |
| [4] | Reddy GB, Khandare AL, Reddy PY, et al. Antioxidant defense system and lipid peroxidation in patients with skeletal fluorosis and in fluoride-intoxicated rabbits[J]. Toxicol Sci, 2003, 72 : 363–368. DOI:10.1093/toxsci/kfg030 |
| [5] | Oncü M, Kocak A, Karaoz E, et al. Effect of long-term fluoride exposure on lipid peroxidation and histology of testes in first-and second-generation rats[J]. Biol Trace Elem Res, 2007, 118(3) : 260–268. DOI:10.1007/s12011-007-0036-6 |
| [6] | 李省, 陈悦, 许启泰, 等. 自由基与氟中毒对RNA代谢影响[J]. 中国公共卫生, 2007, 23(1) : 113. |
| [7] | Bouaziz H, Croute F, Boudawara T, et al. Oxidative stress induced by fluoride in adult mice and their suckling pups[J]. Exp Toxicol Pathol, 2007, 58(5) : 339–349. DOI:10.1016/j.etp.2006.11.004 |
| [8] | Wang J, Chu H, Zhao H, et al. Nitricoxide synthase-induced oxidative stress in prolonged alcoholic myopathies of rats[J]. Mol Cell Biochem, 2007, 304(1-2) : 135–142. DOI:10.1007/s11010-007-9494-6 |
| [9] | Jin XQ, Xu H, Shi HY, et al. Fluoride-induced oxidative stress of osteoblasts and protective effects of baicalein against fluoride toxicity[J]. Biol Trace Elem Res, 2007, 116(1) : 81–89. DOI:10.1007/BF02685921 |
| [10] | 朱秋丽, 樊婷, 蔺新英, 等. 过量氟和适量硒对新西兰兔血脂及血液流变的影响[J]. 环境与健康杂志, 2008, 25(7) : 590–592. |
 2009, Vol. 25
2009, Vol. 25