2. 山东大学第二医院骨科;
3. 山东省立医院脊柱外科;
4. 山东省疾病预防控制中心
后纵韧带骨化(Ossification of the Posterior Longitudinal Ligament of the Spine, OPLL)属于脊柱韧带异位骨化性疾病, 局部机械应力异常、椎间盘突出、遗传因素、全身内分泌因素及生长因子等多种因素与后纵韧带骨化有关, 但迄今尚未得到肯定的结论〔1〕。成纤维细胞是脊柱韧带的主要成分, 研究表明, 成纤维细胞在骨折愈合和骨关节炎的发生过程中具有成骨潜能〔2〕。为观察成纤维细胞在后纵韧带骨化中的作用, 探讨后纵韧带骨化的发病机制, 本研究建立后纵韧带的体外培养成纤维细胞系, 观察脊柱后纵韧带骨化及骨化细胞表型特点。结果报告如下。
1 材料与方法 1.1 材料胎牛血清(杭州四季青生物制剂公司); 盐酸四环素(华美生物工程公司); 碱性磷酸酶(ALP)测定试剂盒(广州标佳科技有限公司); 骨钙素测定试剂盒(北京东亚免疫技术研究所); ZEISS型荧光显微镜(德国蔡司公司); G2倒置相差显微镜(日本Olympus公司); LS-3801型全自动γ闪烁计数仪(美国Beckman公司); 超净工作台(苏州净化设备公司)。
1.2 方法 1.2.1 标本来源OPLL患者非骨化部位标本, 取白颈前路手术中切除的非骨化部位的后纵韧带或此种病患者后路开门减压手术中切除的棘间或棘上韧带; 非OPLL患者标本(对照组), 取自脊髓型颈椎病患者或颈椎外伤患者手术中切除的脊柱韧带。标本获取均经患者同意以及山东大学齐鲁医院、第二医院伦理学委员会批准。
1.2.2 脊柱韧带细胞分离、培养与观察以组织块培养法建立脊柱韧带细胞系, 收集第3代以后的细胞用于实验。细胞以1×105/mL的密度接种于铺有盖玻片的6孔培养板内, 用于免疫组织化学实验; 细胞以5×104/孔的密度接种于24孔培养板中, 每组设3个复孔, 用于检测细胞增殖。共建立8个后纵韧带骨化细胞系(OL1~OL8)及7个非后纵韧带骨化细胞系(NL1~NL7)。逐日在倒置相差显微镜下观察原代与传代培养细胞的贴壁生长、产生分泌物并形成骨小结节的情况。
1.2.3 胶原、粘多糖及钙盐检测(1)采用甲苯胺蓝染色显示胶原的分泌; 细胞浆及结节呈蓝色异染为胶原分泌阳性; (2)采用阿尔新兰(AB)染色显示粘多糖分泌, 不透光结节呈蓝色为粘多糖分泌阳性; (3)采用茜素红S (ARS)染色显示钙盐沉积情况, 细胞中出现橘红色颗粒为钙盐沉积阳性; (4)采用趋骨性荧光四环素标记钙盐沉积, 细胞长满玻片后, 向培养板内加入四环素, 使其终浓度为50mg/L, 将培养板放入CO2培养箱中继续培养40 min, 换新鲜培养液后继续培养30 min, 标本经磷酸盐缓冲液(PBS)漂洗, 冷丙酮固定后做落射荧光观察, 经四环素标记的钙盐呈金黄色荧光反应。
1.2.4 碱性磷酸酶(ALP)及骨钙素(OC)检测采用Gomori氏改良钙钴法进行ALP染色, 胞浆内有黑色颗粒为ALP阳性; ALP活性测定及骨钙素(OC)的分泌测定参照文献〔3〕进行。
1.3 统计分析采用SPSS 13.0软件进行两组间的单因素方差分析。
2 结果 2.1 显微镜观察比较(图 1, 2)
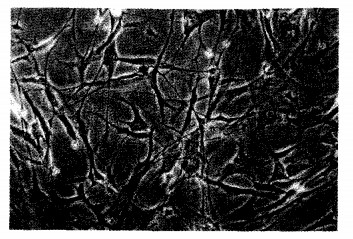
|
注:OL细胞形以多角形为主,呈分层生长 图 1 OL细胞形态(倒置显微镜, 200×) |

|
注:NL细胞为梭形,呈螺旋状 图 2 NL细胞形态(倒置显微镜, 100×) |
OPLL标本原代培养第l3 d, 韧带小块边缘开始有细胞萌出, 培养第24 d, 韧带间已长满细胞; 细胞系OL1、OL3、OL7、OL8细胞形态以多角形为主, 呈分层生长(图 1)。消化传代培养2.5 h, 细胞粘附贴壁, 24 h后细胞伸展为方形或多角形, 传代培养第7 d, 细胞内可观察到黑色颗粒和透亮小泡及不透亮的小结节, 结节逐步融合扩大, 将多个细胞的一侧突起相连接。细胞系OL2、OL4、OL5、OL6的细胞形态以长梭形为主, 呈放射状分布, 呈现成纤维细胞的表型。NL细胞系的形态呈梭形, 呈放射状、螺旋状(指纹状)生长分布(图 2), 细胞内分泌颗粒较少, 不产生分泌结节。
2.2 韧带细胞表型特征比较(1)胶原分泌:OL细胞传代培养第6 d, 甲苯胺蓝染色显示, 细胞及周围结节均呈阳性反应, 细胞在结节周围呈放射状分布, 传代培养后期少数结节呈蓝染的强阳性反应, 细胞周围不透光结节及蓝黑色结节比例增大。对照组传代第12 d, 细胞胞浆及分泌物中胶原分泌均呈弱阳性。(2)粘多糖分泌:OL细胞传代培养第6 d, 阿尔新兰染色显示, 不透光结节呈蓝色阳性反应, 而NL细胞系结节染色呈阴性。(3)钙盐沉积:OL细胞传代第6 d, ARS染色显示, 部分细胞及分泌物呈弱阳性反应, 大部分结节呈阴性; 随培养时间延长, 阳性比例增加。对照组的细胞胞浆及分泌结节均呈阴性反应。四环素荧光标记结果显示, OL细胞传代培养第6 d, 由细胞分泌物堆积形成的小结节仅有部分呈较弱的金黄色荧光反应; 传代培养中后期大部分结节呈对比度较强的金黄色荧光反应, 且金黄色荧光部位与ARS染色阳性部位一致(图 3); 对照组细胞染色呈弱阳性。
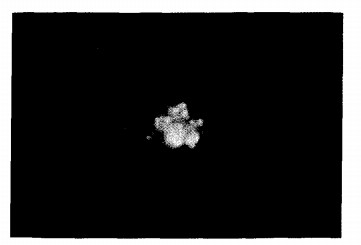
|
注:钙盐结节呈金黄色荧光 图 3 趋骨性荧光四环素标记钙盐沉积(落射荧光, 400x) |
2.3 碱性磷酸酶(ALP)反应
OL细胞传代培养第5~8 d, 细胞胞浆及培养液中均检测出ALP阳性反应的黑色小颗粒(图 4); 对照组细胞染色反应则呈阴性。8个OL细胞系的ALP活性分别为(1.28±0.04), (0.64±O.07), (1.13±0.06), (O.87±0.05), (0.83±0.05), (0.56±0.09), (1.97±0.15), (1.08±0.04) U/mL, 平均值为(1, 05±0.43) U/mL。7个NL细胞系的ALP活性分别为(0.47±0.05), (0.49±0.02), (O.46±03), (0.56±0.03), (0.47±0.04), (0.44±0.02), (0.424±0.03) U/mL, 平均值为(0.47±0.05) U/mL, 2组平均值差异有统计学意义(2=6.45, P < 0.01)。
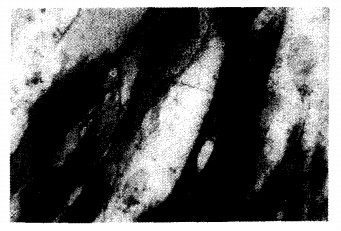
|
注:胞浆呈黑色 图 4 OL细胞ALP染色(钙钴法, 400 ×) |
2.4 骨钙素(OC)分泌
培养3周后, 8个OL细胞系中有4个OL细胞系(OL1、OL3、OL7、OL8)可检测到OC的分泌, 分别是OL1为3.7 ng/mL, OL3为3.5 ng/mL, OL7为2.9 ng/mL, OL8为2.6 ng/mL。OL2, OL4, OL5, OL6及7个NL细胞系未检测到OC的分泌。
3 讨论正常的成纤维细胞具备分泌胶原、粘多糖等功能, 但正常人脊柱韧带一般不发生骨化。本研究结果显示, 4个OL细胞系表现为成骨细胞表型, 而NL细胞系细胞形态表现为成纤维细胞表型。两者在细胞学形态上表现出不一致性, 说明脊柱韧带的成纤维细胞处于一种稳定状态, 在损伤部位和某些病理状态下, 某些促成骨细胞因子可能发生异常分泌, 或韧带成纤维细胞的成骨因子受体表达增加, 成纤维细胞作为某些因子的靶细胞, 在这些细胞因子的作用下, 向成骨细胞发生转化, 成纤维细胞可演变转化为成骨细胞。〔4〕
OC分泌及高ALP活性可作为成骨细胞成熟阶段的标志〔5〕。本研究中4个OL细胞系呈现高的ALP活性并分泌OC, 说明OPLL患者的脊柱韧带具有全身骨化倾向。1wasaki等〔6-7〕研究发现, 机械应力刺激可诱导OPLL患者脊柱韧带细胞成骨基因ALP、OC表达增强, 提示颈椎不稳可能在OPLL发病中起重要作用。骨化的启动机制需进一步探讨。
| [1] | Inamasu J, Guiot BH, Sachs DC. Ossification of the posterior longitudinal ligament: an update on its biology, epidemiology, and natural history[J]. Neurosurgery, 2006, 58(6) : 1027–1039. DOI:10.1227/01.NEU.0000215867.87770.73 |
| [2] | 毕军花, 朱太咏, 石印玉. 成纤维细胞的成骨能力[J]. 中国组织工程研究与临床康复, 2007, 14 : 2733–2736. |
| [3] | 王修文, 颜廷宾, 张佐伦, 等. 骨形态发生蛋白-2对后纵韧带骨化作用[J]. 中国公共卫生, 2008, 24(8) : 977–978. |
| [4] | Sato R, Uchida K, Kobayashi S, et al. Ossification of the posterior longitudinal ligament of the cervical spine: histopathological findings around the calcification and ossification front[J]. Journal of Neurosurg Spine, 2007, 7(2) : 174–183. DOI:10.3171/SPI-07/08/174 |
| [5] | 侯建霞, 曹采方, 孟焕新. 成牙骨质细胞中骨相关标志物的表达[J]. 口腔医学研究, 2002, 18(3) : 149–151. |
| [6] | Iwasaki K, Furukawa KI, Tanno M, et al. Uni-axial cyclic stretch induces Cbfa1 expression in spinal ligament cells derived from patients with ossification of the posterior longitudinal ligament[J]. Calcif Tissue Int, 2004, 74(5) : 448–457. DOI:10.1007/s00223-002-0021-1 |
| [7] | Tanno M, Furukawa KI, Ueyama K, et al. Uniaxial cyclic stretch induces osteogenic differentiation and synthesis of bone morphogenetic proteins of spinal ligament cells derived from patients with ossification of the posterior longitudinal ligaments[J]. Bone, 2003, 33(4) : 475–484. DOI:10.1016/S8756-3282(03)00204-7 |
 2009, Vol. 25
2009, Vol. 25

 , 张佐伦3, 林琳4
, 张佐伦3, 林琳4