2. 江苏省疾病预防控制中心;
3. 上海铁路局徐州疾病预防控制所
1997年, H5N1亚型高致病性禽流感病毒在香港首次跨越禽-人种间屏障, 导致人感染和死亡〔1〕。2003年以来在全球暴发引起公众极大恐慌〔2-3〕。该毒株已被全球卫生机构认定为具有引发流感大流行潜在能力〔4〕。如果能迅速生产疫苗并有充分的数量供应, 则可减少疾病大流行的发病率和死亡率〔5〕。江苏省疾病预防控制中心于2007年9月-2008年3月, 对华兰生物公司和中国军事医学科学院研制的大流行流感疫苗, 在高邮市健康成人中进行了Ⅰ期临床试验。现将对其安全性观察结果报告如下。
1 对象与方法 1.1 对象从2007年9月开始, 在高邮市16~60岁常住健康人群中, 按照自愿报名、知情同意、遵从入选和排除标准的原则进行志愿者筛选。筛选标准:近期无流感病毒感染史、无流感疫苗接种史及接种禁忌症, 筛选合格志愿受试者132名。
1.2 方法 1.2.1 疫苗及接种方法(1)疫苗:利用反向遗传技术, 由A/Vietnam/1203/2004(H5N1)和A/Perto Rico/8/34(PR8)(H1N1)重配的VNH5NI-PR8/CDC-RG疫苗候选株接种鸡胚尿囊腔, 培养收获病毒液, 经灭活、浓缩、纯化、裂解, 加入氢氧化铝佐剂吸附后制成, 经中国药品生物制品检定所检定, 该制品与John J Treanor等研究所用疫苗毒株一致〔6〕。试验用疫苗为注射剂型, 3个剂量均为0.5 mL/瓶; 安慰剂对照为不含抗原的铝佐剂(铝含量0.6 mg/0.5 mL)对照液。(2)接种方法:采用单中心、随机、双盲安慰剂对照设计, 设7.5, 15.0, 30.0 μg 3个剂量试验疫苗组和1个安慰剂对照组, 每组33人, 按0, 21 d免疫程序, 随机接种已编盲疫苗, 上臂三角肌肌内注射0.5 mL。
1.2.2 安全性观察评价不同剂量大流行流感裂解疫苗接种成人后的安全性。(1)全身和局部不良反应观察:全身反应指标包括:发热反应、变态反应、头痛、疲劳、乏力、恶心、呕吐、腹泻、肌肉痛、咳嗽等。局部反应指标包括:疼痛、红、肿、硬结、瘙痒等〔7〕。局部与全身反应均分为轻度(1级)、中度(2级)、严重(3级)、潜在的生命危胁(4级)〔7〕。(2)一般生命体征检查:每针次疫苗接种前及接种24 h后, 对受试者进行一般生命体征(心率、血压、呼吸)检查, 对疫苗安全性进行综合评估。(3)血常规及肝肾功能检测:每针次疫苗接种前及接种后24 h对受试者进行血常规及血生化检测, 对疫苗安全性进行综合评估。
1.3 统计分析病例报告表(CRF)录入核查。采用χ2检验或Fisher (精确概率法)分析试验组和安慰剂对照组局部、全身接种反应以及相关不良事件/反应发生率。
2 结果 2.1 基本情况132名志愿者进行了疫苗全程接种和安全性观察, 无失访发生。132名受试者, 年龄23~58岁, 平均(38.33±8.54)岁; 男性100名, 女性32名, 男女性别比为3: 1, 各组间性别、年龄构成差异无统计学意义(χ2=1.65, P=0.6481; F=1.41, P=0.2435);受试者平均身高(166.23±7.00) cm, 平均体重(67.26±11.17) kg, 各组间差异无统计学意义(F=0.69, P=0.5584; F=0.25, P=0.8597)。
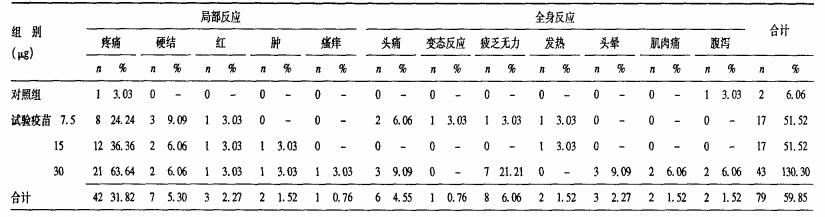
2.2 局部/全身不良反应(表 1)| 表 1 大流行流感疫苗接种后局全身不良反应率比较(每组n=人次) |
由于一个人可同时发生多种局部反应或全身反应, 以人次计算。局部反应55人次, 其中以疼痛发生率最高为31.82%(42/132), 全身反应24人次, 其中以疲倦乏力发生率最高为6.06%(8/132)。4个试验组中, 30.0 μg组反应最多。
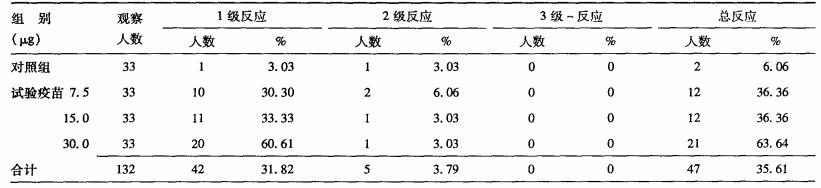
2.3 不良反应强度(表 2)| 表 2 各试验组总体不良反应按严重程度的发生情况 |
各试验疫苗组不良反应以1级反应为主, 发生不良反应的47人中, 只发生局部反应者32人, 发生全身反应者3人, 同时发生全身与局部反应者12人, 单纯局部不良反应占所有不良反应的68.09%。以例数为单位, 各试验组与安慰剂对照组比较, 差异均有统计学意义(χ2=25.282 5, P < 0.0001)。3个剂量试验疫苗组与7.5, 15.0 μg组比较, 30.0 μg组不良反应发生率最高, 差异均有统计学意义(χ2=6.111 1, P=0.013 4;χ2=4.9272, P=0.026 4);所有不良反应均在7 d内恢复。
2.4 局部/全身不良反应严重程度局部反应中, 1级反应发生率为31.82%(42/132), 其中局部1级反应占局部总反应的95.45%, 3个剂量组与安慰剂对照组比较, 差异均有统计学意义(P < 0.05);全身2级反应发生率为2.27%(3/132), 占全身总反应的20.00%(3/15), 各试验组间差异无统计学意义(χ2值=精确概率, P=0.6163);未观察到3级及以上全身不良反应。
2.5 不同针次、年龄不良反应比较各组不良反应以1级为主, 第1针高出第2针100.00% (38/19), 以30.0 μg组最高; 2级不良反应第1针和第2针的发生率均为2.27%, 各组间2级不良反应发生率差异无统计学意义; 无3级~不良反应。各组人群按照16~30岁, 31~40岁, 41~50岁, 51~60岁分组, 经过精确概率法的统计分析, 各组间差异无统计学意义(依次P=0.387 4, P=0.444 7, P=0.956 3, P=0.446 0)。
2.6 生命体征及血液检验接种前当日及接种后24 h监测呼吸、心率及血压, 除7.5, 15.0 μg组每针免疫前后异常率差异有统计学意义外, 其他各项指标差异均无统计学意义。接种前当日及接种后24 h检测血常规、血生化(包括肝功能、肾功能), 差异无统计学意义。
3 讨论一旦H5N1禽流感病毒获得由人传人的能力, 此疫苗的需求量极大, 目前国际上任何一家流感疫苗生产厂都不可能满足供应〔8〕。到目前为止, 美国、法国巴斯德公司和中国北京科兴公司等12家机构已经先后完成I期临床研究。一般认为, 裂解疫苗的免疫效果不如全病毒疫苗〔9〕。
老人和儿童被普遍认为具有对流感的高易感性; 世界卫生组织报道大部分与H5N1感染有关的病例和死亡病例是儿童〔10〕。本研究对所有成人受试者按4个年龄层进行不良反应发生率的比较分析结果显示, 差异无统计学意义。下一步可以将老人和儿童列入研究对象进行观察。
本研究仅对裂解疫苗的安全性进行了分析, 所有受试者均对该疫苗耐受良好, 无严重不良反应, 大部分的局部和全身反应是温和的和短暂的, 与文献报道相近〔10〕。3个试验疫苗组与安慰剂对照组比较局部反应发生率差异有统计学意义, 各试验组间的差异无统计学意义; 观察到的30.0 μg组反应最多, 共发生43人次。第1针接种后发生的反应明显高于第2针, 与前期的报道一致〔7〕。
综上所述, 大流行流感裂解疫苗有较好的安全性, 3个剂量试验疫苗组不良反应发生率明显高于安慰剂对照组, 其中30.0 μg组高于其他组, 但30.0 μg组不良反应仍以局部1级不良反应为主, 无3级及以上不良反应发生。
| [1] | 陈化兰. H5N1禽流感疫苗研究及应用[J]. 动物保健, 2006, 8 : 32–33. |
| [2] | 陈浩, 刘明, 刘春国, 等. H5N1亚型禽流感病毒HA基因核酸疫苗的构建及免疫效果研究[J]. 动物医学进展, 2008, 29(7) : 13–18. |
| [3] | 中国疾病预防控制中心.世界卫生组织报告全球人禽流感疫情统计[R/OL]. [2008-12-16]. http://www.chinacdc.net.cn. |
| [4] | Leroux-Roels I, Borkowski A, Vanwolleghem T, et al. Antigen sparing and cross-reactive immunity with an adjuvanted rH5N1 prototype pandemic influenza vaccine: a randomised controlled trial[J]. Lancet, 2007, 370 : 580–589. DOI:10.1016/S0140-6736(07)61297-5 |
| [5] | 龚震宇, 高筱萍, 傅亚娟. 研制H5N1禽流感人类疫苗所要面对的第一步[J]. 疾病监测, 2005, 20(10) : 560. |
| [6] | Treanor JJ, Campbell JD, Zangwill KM, et al. Safety and immunogenicity of an inactivated subvirion influenza A (H5N1) vaccine[J]. The New England Journal of Medicine, 2006, 354(13) : 1343–1351. DOI:10.1056/NEJMoa055778 |
| [7] | 国家食品药品监督管理局. 预防用疫苗临床试验不良反应分级标准指导原则[M]. 北京: 国家食品药品监督管理局, 2005. |
| [8] | 郭元吉. 禽流感的十大热点问题[J]. 科学, 2006(1) : 24–29. |
| [9] | 朱智勇, 丁晓航, 朱函坪, 等. 人用H5N1禽流感疫苗检定评价[J]. 中国公共卫生, 2007, 23(4) : 388–390. |
| [10] | Lin J, Zhang J, Dong X, et al. Safety and immunogenicity of an inactivated adjuvanted whole-virion influenza A (H5N1) vaccine: a phase I randomised controlled trial[J]. Lancet, 2006, 368 : 991–997. DOI:10.1016/S0140-6736(06)69294-5 |
 2009, Vol. 25
2009, Vol. 25