2. 大连医科大学附属第一医院心内科;
3. 大连医科大学附属第一医院妇产科
研究表明,氧化应激是砷中毒的作用机制之一,氧化应激的产物活性氧群(ROS)在砷所引起的各类细胞损伤中起主要作用〔1〕。ROS引起组织和器官的损伤可能与细胞内许多抗氧化系统功能的改变有关,如影响体内重要的抗氧化酶如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽相关酶类等〔2-3〕。不同种属、不同组织和细胞对砷化合物的敏感性与SOD和CAT的活性密切相关,而砷中毒最明显的表现是皮肤角化和色素脱失,严重的可出现皮肤癌,因而本研究采用人永生化皮肤角质形成细胞株(HaCaT)作为研究对象,拟从抗氧化能力探讨砷作用于人皮肤细胞后ROS、脂质过氧化产物丙二醛(MDA)的生成情况以及对抗氧化酶SOD和CAT活性的影响。
1 材料与方法 1.1 试剂和仪器(1)试剂:亚砷酸钠(NaAsO2,美国Sigma公司); 2’7’-二乙酰二氯荧光素(DCFH-DA,美国Sigma公司); 硫代巴比妥酸(上海试剂二厂); 考马斯亮兰(上海卓康生物科技有限公司)。(2)仪器:超净工作台(苏净集团安泰公司); 二氧化碳恒温培养箱(荷兰Heraeus公司); 倒置相差显微镜(日本Olympus公司); 流式细胞仪(美国BD公司); 紫外分光光度计(日本Shimadzu公司); 荧光分光光度计(日本Hitachi公司); 722光栅分光光度计(上海第三分析仪器厂)。
1.2 细胞培养和处理HaCaT来自教研室保存细胞株,常规培养于完全培养基,5%CO2,37 ℃条件下培养,隔日换液,待细胞进入对数生长期,加入含有不同浓度0(对照组),2.5,5,10和20 μmol/L的NaAsO2培养基。
1.3 ROS含量检测受试物作用24 h后收集细胞,制成单细胞悬液,在各组细胞悬液中加入终浓度为10 μmol/L的DCFH-DA,37 ℃孵育20 min,磷酸盐缓冲液(PBS)洗1次后立即用流式细胞仪进行检测,激发波长488 nm,发射波长525 nm,每次计数10 000个细胞,用Cell Quest软件进行分析,以二氯荧光素的平均荧光强度表示ROS含量。
1.4 MDA测定按照文献〔4〕,用改良硫代巴比妥酸荧光法测定细胞内丙二醛(MDA)含量,测定条件,λex:515 nm; λem:550 nm。
1.5 SOD活性检测-70 ℃反复冻融细胞3次,4 ℃、10 000 g离心20 min,取上清,用Bradford法测定蛋白浓度〔5〕; 用Nitrate-kit法检测细胞裂解上清液中SOD活性〔6〕,用蛋白浓度校正,活性单位为NU/mg。
1.6 CAT活性测定用紫外速率直接法测定CAT活性。在测定管中加入0.015 mol/L和H2O2 2.8 mL及0.2 mL的样品溶液,在240 nm处记录初始紫外吸收值AO及30 s吸收值A30,计算CAT活性,用蛋白值校正,活性单位用K/g蛋白表示。
1.7 统计分析采用SPSS 11.0软件进行分析; 组间均值比较采用单因素方差分析。
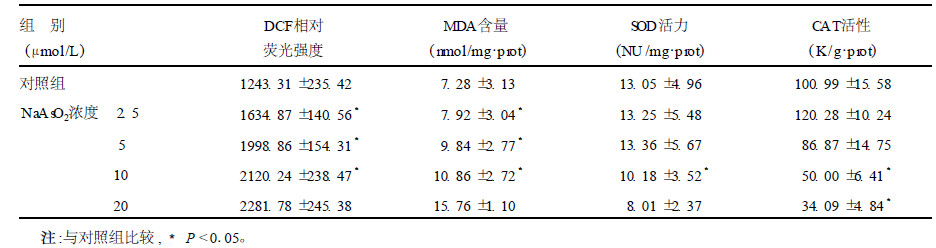
2 结果 2.1 NaAsO2 对HaCaT细胞内ROS含量影响用DCFH-DA对HaCaT细胞染色后,从流式细胞仪获取的细胞图像经统计学分析,2.5 μmol/L的NaAsO2可使细胞内DCF的荧光强度明显增高(P < 0.05),且随剂量增高,DCF的荧光强度逐渐增高。
2.2 NaAsO2对HaCaT细胞内MDA含量影响NaAsO2作用后,各实验组(2.5,5,10和20 μmol/L) HaCaT细胞内的MDA含量均明显增加(P < 0.05),且随剂量增高,MDA含量逐渐增高。
2.3 NaAsO2对HaCaT细胞SOD活力影响与对照组比较,2.5和5 μmol/L组细胞内SOD活力无明显改变,而10和20 μmol/L组细胞内SOD活力明显下降(P < 0.05)。
2.4 NaASO2对HaCaT细胞CAT活性的影响2.5 μmol/L NaAsO2组CAT的活性有所增高,但与对照组比较差异无统计学意义; 而10和20 μmol/L的NaAsO2使细胞内CAT活性明显下降(P < 0.05),已降至对照组水平的50%和34%。
| 表 1 NaAsO2对HaCaT细胞各项指标的影响(x±s) |
3 讨论
DCFH-DA是一种非极性荧光染料,可以自由通过细胞膜,进入细胞后被细胞非特异性内脂酶去脂形成DCFH,DCFH本身不发荧光,但若被过氧化氢等氧化后即可形成发荧光的DCF,通过DCF荧光强度的变化可检测细胞内的ROS。各ROS均可氧化DCFH形成DCF,因而被广泛用于检测细胞中的氧化应激状态。本研究发现,低浓度的NaAsO2即可引起HaCaT细胞ROS产生增多,ROS增多可能引起机体氧化和抗氧化的失衡,引起细胞损伤,如脂质过氧化。本研究也发现,砷可引起细胞内脂质过氧化的产物MDA含量明显增多,表明砷进入细胞后生成的ROS损伤了脂质。此外,砷还可以通过ROS损伤DNA、蛋白质等大分子物质〔7〕。
本研究还发现,砷可抑制SOD和CAT的活力,SOD是体内一种重要的抗氧化酶,用于清除·O2-。有实验证明,大鼠摄入iAsⅢ后细胞内SOD活性明显降低〔8〕,加入SOD后砷对巨噬细胞的毒作用减轻〔9〕,CAT也是细胞内主要抗氧化酶之一,在抗氧化过程中发挥着重要作用。2.5 μmol/L的NaAsO2可引起CAT活性的轻微增高,这可能是细胞内的一种应激反应,而当NaAsO2浓度增大时,对CAT的抑制作用非常明显。结果表明,砷对体外培养的皮肤细胞的抗氧化系统具有一定的损伤作用。
| [1] | Beyersmann D, Hartwig A. Carcinogenic metal compounds:recent insight into molecular and cellular mechanisms[J]. Arch Toxicol, 2008, 82(8) : 493–512. DOI:10.1007/s00204-008-0313-y |
| [2] | Nandi D, Patra RC, Swarup D. Oxidative stress indices and plasma biochemical parameters during oral exposure to arsenic in rats[J]. Food Chem Toxicol, 2006, 44(9) : 1579–1584. DOI:10.1016/j.fct.2006.04.013 |
| [3] | 蒋玲, 李玲, 吴君, 等. 氧化应激致慢性水砷暴露小鼠肝损伤作用[J]. 中国公共卫生, 2008, 24(5) : 593–595. |
| [4] | 张秀明, 严丽娟, 柴建开, 等. 改良硫代巴比妥酸荧光法测定血清过氧化脂质[J]. 生物化学与生物物理进展, 1996, 13(2) : 175–179. |
| [5] | Bradford MM. A rapid and sensitive method for the quantiation of microgram quantities of protein utilzing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72 : 248–254. DOI:10.1016/0003-2697(76)90527-3 |
| [6] | Yoshihiko Q. Reevaluation of assay methods and establishment of kit for superoxide dismutase activity[J]. Anal Biochem, 1984, 142(2) : 290–296. DOI:10.1016/0003-2697(84)90467-6 |
| [7] | Banerjee M, Sarma N, Biswas R, et al. DNA repair deficiency leads to susceptibility to develop arsenic-induced premalignant skin lesions[J]. Int J Cancer, 2008, 123(2) : 283–287. DOI:10.1002/(ISSN)1097-0215 |
| [8] | Gupta R, Flora SJ. Protective value of Aloe vera against some toxic effects of arsenic in rats[J]. Phytother Res, 2005, 19(1) : 23–28. DOI:10.1002/(ISSN)1099-1573 |
| [9] | Sakurai T, Kaise T, Matsubara C. Inorganic and methylated arsenic compounds induce cell death in murine macrophages via different mechanisms[J]. Chem Res Toxicol, 1998, 11(4) : 273–283. DOI:10.1021/tx9701384 |
 2009, Vol. 25
2009, Vol. 25