2. 沈阳出入境检验检疫局;
3. 辽宁出入境检验检疫局;
4. 西藏出入境检验检疫局
李斯特菌是一种病原菌。李斯特菌食品传播亦渐被重视〔1〕。在李斯特菌属的分类种中, 单核细胞增生李斯特菌对人类致病性最强, 绵羊李斯特菌对人类也有一定的致病性, 其余李斯特菌的致病性少有报道〔2〕。建立食品中致病菌快速检测技术, 可保障食品安全。基于PCR技术的分子生物学检测方法是最有效的快速检测手段, 已被广泛应用于食源性致病菌的检测〔3-5〕。有关绵羊李斯特菌的PCR快速检测技术研究报道较少。本研究以绵羊李斯特菌为检测对象, 基于PCR结合变性高效液相色谱(DHPLC)技术, 建立食品中绵羊李斯特菌的快速检测方法, 以达到快速、简便、准确检测的目的。现报告如下。
1 材料与方法 1.1 材料 1.1.1 菌株供试菌株为37株。包括单核细胞增生李斯特菌等26株标准菌株(美国典型菌种保藏中心), 鼠伤寒沙门菌等3株标准菌株(中国医学微生物菌种保藏管理中心); 威尔斯李斯特菌等8株菌株(本实验室和吉林、内蒙、山东等检验检疫局实验室)。
1.1.2 食品样品检测样品来源于市售和从美国、澳大利亚等国进口的鸡肉、羊排、猪蹄等食品。
1.1.3 培养基和试剂细菌基因组DNA提取试剂及Ex Taq等试剂(大连宝生物工程有限公司); 三乙胺乙酰盐(TEAA, 美国Transgenomic公司)色谱纯; 乙腈(美国Fisher公司)色谱纯; DHPLC缓冲液:缓冲溶液A为0.1 mmol/L TEAA; 缓冲溶液B为0.1 mol/L TEAA + 25%乙腈。
1.1.4 主要设备基因扩增仪(美国ABI公司); 变性高效液相色谱(美国Transgenomic公司)。
1.1.5 引物的设计与合成根据Liu D等〔5〕报道的绵羊李斯特菌N-acetylmuramidase-like蛋白基因序列, 采用DNA-MAN 8.0软件设计引物。针对绵羊李斯特菌特异性检测, 自主设计的引物序列为: 5′-GCATGGCTTCATTTGTTTATCAC-3′, 5′-TTATCCACAGTTCTAAGCACTCC-3′, 预期扩增片段为367 bp。引物由宝生物工程(大连)有限公司合成。
1.2 方法 1.2.1 参考菌株DNA模板库的建立按传统的培养方法分别增菌培养供试的37株参考菌株。取参考菌株的培养液1.5 mL, 12 000 r/min离心1 min, 吸弃上清, 取沉淀, 采用细菌DNA提取试剂盒(日本TaKaRa公司)提取细菌DNA, 建立参考菌株DNA模版库, 保存于-20 ℃, 备用。
1.2.2 PCR扩增条件(1) PCR反应体系(25 μL)为: 10倍PCR缓冲液2 μL、2条引物(10 μmol/L)各1 μL、dNTPs (10 mmol/L)2 μL、Taq DNA聚合酶(5 U/μL) 0.2 μL、模板DNA (10~50 ng) 2 μL、水16.8 μL。(2) PCR反应条件: 94 ℃预变性3 min; 94 ℃变性40 s, 56 ℃退火40 s, 72 ℃延伸40 s, 进行35个循环; 72 ℃延伸7 min, 4 ℃保存反应产物。
1.2.3 DHPLC分析条件色谱柱: PS-DVB & C18 DNASep色谱柱(4.6 mm × 50 mm, 粒度3 μm); 柱温: 50 ℃; 流动相:缓冲溶液A浓度为50.2%, 缓冲溶液B浓度为49.8%;流速: 0.9 mL/min; 检测器:荧光检测器(光源: 150 W Xenon灯; 激发谱带宽: 15 nm; 发射谱带宽: 15.3 nm; 检测灵敏度:在波长350 nm积分2 s)。上样量: PCR产物5 μL。
1.2.4 特异性试验对37株参考菌株的DNA模板库进行PCR-DHPLC检测。在参考菌株的选取中, 有2株是绵羊李斯特菌目的菌株, 此外还包括绵羊李斯特菌的近源种, 即同属于李斯特菌属且与绵羊李斯特菌具有较高同源性的菌株。如单核细胞增生李斯特菌、英诺克李斯特菌、威尔斯李斯特菌、西尔李斯特菌、格氏李斯特菌等9株菌株以及绵羊李斯特菌的非近源种, 如沙门菌、阪崎肠杆菌、金黄色葡萄球菌等26株菌株。
2 结果 2.1 特异性试验(图 1, 图 2)
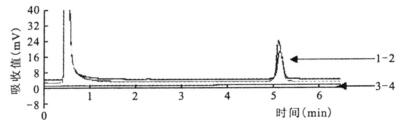
|
注:绵羊李斯特菌ATCC 19119;2:绵羊李斯特菌分离株;3:大肠埃希菌阴性对照;4:空白对照 图 1 绵羊李斯特菌检测结果的DHPLC检测图谱 |
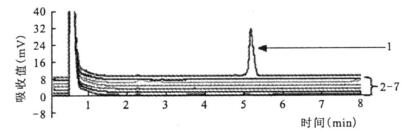
|
注:1:绵羊李斯特菌;2~7:单增李斯特菌、英诺克李斯特菌、威尔斯李斯特菌、西尔李斯特菌、格氏李斯特菌、大肠埃希菌。 图 2 绵羊李斯特菌特异性检测结果的DHPLC检测图谱 |
经PCR-DHPLC检测, 在供试的37株参考菌株中, 只有绵羊李斯特菌出现阳性吸收峰。其余所有菌株均呈阴性。图 1和图 2仅显示了部分菌种的检测结果图谱。试验结果表明:本研究自主设计的绵羊李斯特菌检测引物具有很好的检测特异性。
2.2 样品中分离菌株的检测与克隆测序本研究从市售和进口的肉制品等食品中分离出4株可疑绵羊李斯特菌, 经PCR-DHPLC检测均为阳性。该菌的主要生理生化特征为革兰阳性小杆菌, 菌株刺种到5%的绵羊血或马血琼脂平板上, 35 ℃培养48 h, 在明亮的光照下, 观察经穿刺的血琼脂平板, 可见产生界限明显的较大溶血环。生化反应为:触酶试验阳性; 分解葡萄糖、麦芽糖、七叶苷、木糖, 不分解鼠李糖、甘露醇; 硝酸盐还原试验阴性。上述反应都符合绵羊李斯特菌的生化特性。为了证实该分离株经DHPLC检测出的阳性吸收峰为绵羊李斯特菌N-acetylmuramidase-like蛋白基因片段, 将其中的一个DHPLC阳性吸收峰产物回收后进行了克隆和测序, 将所测出的基因序列提交Genbank并被接收(Genbank编号FJ772430);经与Genbank中原有的绵羊李斯特菌(Gen-bank编号: AY542872) DNA序列比对, 两者序列的吻合率为100%, 证明该分离株的DHPLC阳性吸收峰为绵羊李斯特菌N-acetylmuramidase-like蛋白基因片段。
3 讨论对于食品中绵羊李斯特菌的检测, 目前以分离培养、生化鉴定为主, 传统的细菌培养和鉴定是一项既耗时又复杂的工作, 由于某些生化试剂、血清等质量不稳定、特异性不好等因素, 经常给鉴定的结果带来差异, 同时李斯特菌属的几个种在菌落形态和生化特征上经常不易区分, 影响了食品的安全管理和有效监测。
多年来, 我们一直持续性地致力于食源性致病菌的快速检测方法的探索和建立的研究, 并取得了一定的研究成果〔3, 6-11〕。本研究表明, 综合比较各种快速检测方法, 比如常规PCR、实时PCR、胶体金试纸条、基因芯片技术等, PCR-DHPLC方法具有很好的特异性、灵敏度和稳定性。而且, 该方法的检测成本较其他方法大大降低, 具有更加广阔的应用推广空间。
本研究建立的绵羊李斯特菌PCR-DHPLC检测方法具有稳定、特异、灵敏、快捷的特点, 完全适用于食品中绵羊李斯特菌的快速检测。同时, 该方法的建立为预防绵羊李斯特菌食源性疾病的暴发和流行起到了积极的作用。
| [1] | 曹际娟. 食品微生物学与现代检测技术[M]. 大连: 辽宁师范大学出版社, 2006: 150-187. |
| [2] | 陈健舜, 江玲丽, 方维焕. 李斯特菌毒力因子及其进化[J]. 微生物学报, 2007, 47(4) : 738–742. |
| [3] | 金大智, 谢明杰, 曹际娟. 食品中单增李氏菌实时PCR鉴定方法[J]. 辽宁师范大学学报, 2003, 26(1) : 73–76. |
| [4] | 徐伟, 李素芳, 刘军. PCR技术检测单核细胞增生李斯特氏菌研究进展[J]. 生物技术通报, 2008(1) : 95–112. |
| [5] | Liu D, Ainsworth A J, Austin F W, et al. PCR detection of a putative N-acetylmuramidase gene from Listeria ivanovii facilitates its rapid identification[J]. Vet Microbiol, 2004, 101(2) : 83–89. DOI:10.1016/j.vetmic.2004.03.015 |
| [6] | 曹际娟, 闫平平, 于珂, 等. 变性高效液相色谱检测霍乱弧菌[J]. 辽宁师范大学学报, 2008, 31(3) : 348–352. |
| [7] | 徐君怡, 曹际娟, 郑秋月, 等. 变性高效液相色谱检测食品中致泻性大肠杆菌[J]. 微生物学报, 2008, 48(11) : 1526–1531. |
| [8] | 曹际娟, 赵昕, 孙哲平, 等. PCR结合变性高效液相色谱快速检测水产品中河流弧菌[J]. 中国卫生检验杂志, 2008, 18(11) : 7812–9812. |
| [9] | 熊国华, 于莉, 曹际娟, 等. 单增李斯特菌免疫胶体金试纸条快速检测[J]. 中国公共卫生, 2008, 24(2) : 248–249. |
| [10] | 王金玲, 曹际娟, 乔洪伟, 等. 应用基因芯片检测动物性食品中主要致病菌[J]. 中国兽医学报, 2007, 27(4) : 485–489. |
| [11] | 王耀, 郑秋月, 曹际娟. SYBR (R) GreenⅠ实时PCR快速检测沙门菌[J]. 中国食品卫生杂志, 2006, 18(4) : 314–317. |
 2009, Vol. 25
2009, Vol. 25

 , 王顺芝4, 李建民4, 赤列加措4, 曹远银1
, 王顺芝4, 李建民4, 赤列加措4, 曹远银1