神经细胞凋亡是阿尔茨海默病(Alzheimer's disease, AD)、帕金森病等神经退行性疾病的重要病理作用机制之一〔1〕。胺基脲敏感性胺氧化酶(SSAO)广泛分布于内皮、平滑肌、脂肪细胞,与血管性痴呆和阿尔茨海默病等密切相关〔2, 3〕, 能催化体内胺类物质分解释放大量醛类物质如内源性甲醛(Formaldehyde, FA)〔2〕。后者直接诱导细胞凋亡〔4〕, 诱导形成tau淀粉样聚集物,诱导人神经母细胞瘤细胞(SH-SY5Y神经瘤细胞)凋亡〔5〕; 启动内皮功能损伤导致心血管疾病〔3〕。本研究以肾上腺嗜铬细胞瘤细胞(PC12)为实验对象,观察甲醛诱导PC12凋亡,探讨其作用机制。
1 对象与方法 1.1 材料PC12细胞是大鼠肾上腺髓质嗜铬细胞瘤分化的细胞株,具有典型的神经细胞特征(美国菌种保藏中心,ATCC细胞库); RPMI-1640培养基(美国Gibco公司); 小牛血清(杭州四季青公司); bisBenzimide H 33258 (Hoechst 33258, 凋亡检测试剂盒)染色试剂盒、四甲基偶氮噻唑蓝(MTT)、磷酯酰丝氨酸结合蛋白-异硫氢酸荧光素(Annexin V-FITC)试剂盒、蛋白含量(Western Blot荧光法)检测试剂盒,十二烷基磺酸钠(SDS)、土温-20(Tween-20)、甘氨酸(美国Sigma公司); 兔抗鼠半氨酸蛋白酶-3(Caspse-3)多抗(美国Neomarkers公司); 兔抗鼠β-肌动蛋白(β-actin) IgG、辣根过氧化酶标记(HRP)羊抗兔IgG (美国Santa Cruze公司); 丙烯酰胺和N, N' -亚甲基双丙稀酰胺、四甲基乙二胺(TEMED)、蛋白质浓度(BCA)试剂盒(美国Calbiochem公司); 胰蛋白酶(美国Amerseco公司); 诱导型一氧化氮合酶(iNOS)抑制剂氨基胍(Aminoguandine hydrochloride, AG, 美国Alexis公司); 一氧化氮(NO)、乳酸脱氢酶(LDH)测定试剂盒、一氧化氮合酶分型(NOS, iNOS)测定试剂盒(南京建成生物工程公司); 甲醛、过氧化氢(H2O2)及磷酸缓冲液(PBS)试剂均为国产分析纯。
1.2 方法 1.2.1 细胞培养及实验分组含15%小牛血清RPMI-1640培养基稀释细胞至1×105, 1.2×105, 2×105个/mL,分别接种至96, 24, 6孔培养板中,以甲醛、H2O2、iNOS抑制剂AG分别处理细胞,24 h后收集细胞观察各指标。正常对照组:与处理组等体积的PBS; 甲醛处理组:终浓度分别为20, 40, 80, 160 μmol/L甲醛; 药物保护组(甲醛+iNOS抑制剂)100 μmol/L iNOS抑制剂AG作用24 h后,80 μmol/L甲醛; 阳性对照组:终浓度为100 μmol/L过氧化氢。
1.2.2 细胞形态学检测去培养基,4%多聚甲醛固定10 min; 磷酸盐缓冲液(PBS)洗2遍,摇床洗涤每次3 min,去液体; Hoechst 33258荧光染色法检测细胞凋亡按说明书操作。荧光显微镜(Olympus BX51)观察细胞内荧光并拍照。
1.2.3 细胞死亡测定Annexin V-FITC结合流式细胞仪检测细胞凋亡与坏死。按照Annexin V-FITC试剂盒说明书操作,应用流式细胞仪进行分析。
1.2.4 MTT法检测细胞存活率PC12细胞培育于96孔培养板,MTT法检测细胞活力,酶标仪上读取570 nm处吸光度(A)值。生长抑制率(inhibitory rate, IR)=(对照组A值-实验组A值)/对照组A值×100%。
1.2.5 细胞培养液中LDH活性测定分光光度法检测LDH漏出量,在WFJ 2100型分光光度计波长440 nm处读取吸光度。根据试剂盒说明书计算LDH活力。
1.2.6 细胞上清液中NO含量测定硝酸还原酶法检测细胞上清液中NO的含量。根据试剂盒说明书测定NO浓度。
1.2.7 细胞内NOS活性的测定根据试剂盒说明书测定并计算总NOS活力和iNOS活力。
1.2.8 免疫印迹分析(Western blot)2×SDS加样缓冲液裂解PC12细胞,应用BCA试剂盒进行样本蛋白定量。按照Western blot荧光检测试剂盒检测Caspase-3蛋白表达,Actin条带作为内对照,测定显带密度。
1.3 统计分析采用SPSS13.0软件进行统计分析; 组间差异采用单因素方差(One-way ANOVA)分析,采用Sigma Plot10.0软件制作统计图。
2 结果 2.1 不同浓度甲醛对细胞形态的影响荧光显微镜观察,正常细胞核大,均匀低强度荧光; 典型凋亡细胞体积缩小、核呈致密浓染的固缩形式或碎块状致密荧光,颜色发白,随甲醛浓度增高加重,160 μmol/L甲醛未进一步加重细胞凋亡。过氧化氢组细胞体缩小、核固缩、呈碎块状致密荧光凋亡形态。AG明显减少细胞凋亡。
2.2 甲醛对PC12细胞凋亡的影响(图 1)
|
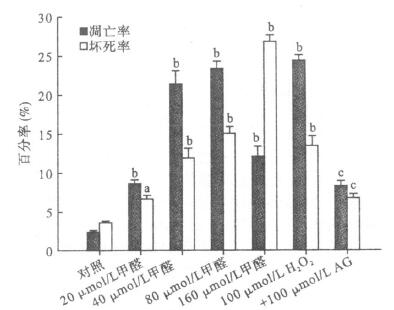
注:与对照组比较, aP<0.05, bP<0.01;与80 μmol/L甲醛组比较, cP<0.01, (x±s, n=3)。 图 1 Annexin-V-FITC加PI双染检测PC12细胞早期凋亡与坏死 |
Annexin V-FITC/碘化丙啶(PI)双染色流式细胞术分析:活细胞FITC及PI均低染(FITC-PI-),流式细胞分析图的左下区细胞簇; 凋亡细胞FITC高染、PI低染(FITC+PI-), 为右下区细胞簇; 坏死细胞FITC和PI均高染(FITC+PI+),为右上区细胞簇。PC12细胞凋亡率随甲醛浓度逐渐增加。从(2.47±0.23)%升高至(23.39±1.02)%,与对照组比较差异均有统计学意义(P < 0.01);细胞坏死率也同时增高,以160 μmol/L甲醛最明显。AG明显减少细胞死亡,与80 μmol/L甲醛浓度组比较,差异有统计学意义(P < 0.01)。
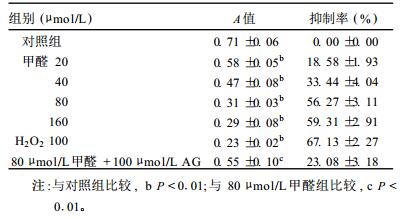
2.3 甲醛对PC12细胞生长活性的影响(表 1)| 表 1 不同浓度甲醛对PC12细胞生长抑制率的影响( x±s, n=18) |
甲醛明显抑制PC12细胞生长活性,过氧化氢组A值明显减小,与对照组比较差异有统计学意义(P < 0.01),细胞生长抑制率增加。AG明显减轻甲醛对细胞生长的抑制作用。
2.4 甲醛对PC12细胞上清液LDH活力的影响甲醛诱导细胞上清液LDH活力呈现2个特点:较低剂量( < 40 μmol/L)甲醛使细胞上清液LDH活性稍有降低; 中、高剂量(>40 μmol/L)甲醛明显诱导LDH漏出,从(374.04±15.64) U/L升高至(800.18±24.84) U/L, 与对照组比较,差异有统计学意义(P < 0.01)。过氧化氢组LDH活力(919.36±43.88) U/L, 明显高于对照组(P < 0.01)。AG减轻甲醛诱导的LDH漏出。
2.5 甲醛对PC12细胞上清液中NO的影响随着甲醛浓度增加细胞培养液NO含量从(488.34±33.05)μmol/L逐渐增高至(755.66±17.38)μmol/L, 明显高于正常对照组(P < 0.01)。AG明显减轻甲醛诱导的NO升高,差异有统计学意义(P < 0.01)。
2.6 甲醛对PC12细胞NOS活性的影响(图 2)
|
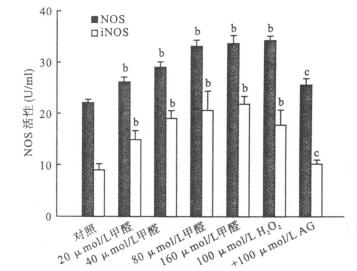
注:与对照组比较, aP < 0.05, bP < 0.01;与80 μmol/L甲醛组比较, cP < 0.01(x±s, n=6) 图 2 不同浓度甲醛对PC12细胞NOS活性的影响 |
甲醛浓度依赖性的增加PC12细胞NOS及其亚型iNOS活性,与对照组比较,差异有统计学意义(P < 0.01)。AG降低甲醛诱导NOS活性,包括iNOS活性的降低,差异有统计学意义(P < 0.01)。
2.7 甲醛对PC12细胞caspase-3蛋白表达的影响(图 3)
|
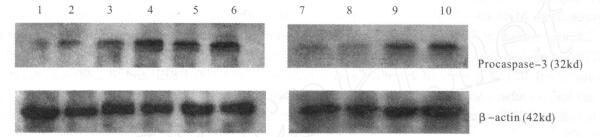
注:1:对照组; 2:20 μmol/L甲醛; 3:40 μmol/L甲醛; 4:80 μmol/L甲醛; 5:160 μmol/L甲醛; 6:100 μmol/L H2O2; 7:对照; 8:80 μmol/L甲醛+100 μmol/L AG; 9:80 μmol/L甲醛; 10:100 μmol/L H2O2。 图 3 不同浓度甲醛对PC12细胞caspase-3蛋白表达影响 |
Western blot结果显示,不同浓度甲醛处理PC12细胞24 h后,随着甲醛浓度的增加,caspase蛋白酶的前体形式procaspase-3蛋白的印迹明显增强,为细胞发生凋亡、caspase蛋白酶发生剪切激活的表现。iNOS抑制剂AG减少procaspase-3蛋白表达。经凝胶成像分析系统分析灰度扫描后,灰度值差异有统计学意义(P < 0.01)。
3 讨论内源性甲醛是SSAO酶催化内源性胺类物质脱氨产生的高反应性物质,具有神经毒性〔2〕, 诱导肝细胞半胱天冬酶(caspase)活化,启动肝细胞凋亡〔6〕; 诱导交联及β淀粉样蛋白形成,进而诱发AD〔2, 3〕。本研究主要有如下发现:(1)浓度依赖性有诱导PC12细胞典型凋亡(Hoechst 33258荧光染色); (2)40 μmol/L甲醛主要诱导凋亡(Annexin V-FITC/PI双染、流式细胞),160 μmol/L甲醛主要诱导细胞坏死; (3)明显降低细胞活力(MTT法),160 μmol/L甲醛组细胞生长抑制率达高峰; (4)甲醛浓度>40 μmol/L时,呈剂量依赖性诱导LDH漏出,iNOS选择性抑制剂AG明显降低甲醛诱导的PC12细胞损伤; (5)甲醛浓度依赖性的增加细胞培养液NO含量的细胞毒性,增加caspase-3和procaspase-3蛋白表达。提示甲醛具有明显的细胞毒性,其机制可能与NOS及caspase-3凋亡途径有关。
过量NO诱导细胞凋亡是脊髓损伤的重要原因,脑内过量释放NO可导致细胞死亡〔7〕。NO生成的关键酶是NOS, iNOS形成的病理性NO是诱导内皮细胞凋亡的主要原因〔8〕。AG明显抑制iNOS活性,改善神经细胞存活率〔9〕。表明iNOS激活是介导甲醛PC12细胞毒性机制。caspase-3是细胞凋亡蛋白级联反应的必经之路〔10, 11〕,甲醛诱导相关基因caspase活化进而导致细胞凋亡〔2, 3〕。NO的供体可开放线粒体通透性转运孔道,释放细胞色素C,激活caspase-3, 导致细胞凋亡〔12〕。本研究发现,甲醛诱导procaspase-3蛋白表达,iNOS抑制剂AG明显的抑制甲醛对procaspase-3激活。提示NO在caspase-3上通过效应蛋白分子procaspase-3诱导PC12细胞凋亡。结果表明,甲醛主要是通过iNOS/NO或激活caspase-3诱导PC12细胞凋亡。
| [1] | Teunissen CE, Vente J, Steinbusch HW, et al. Biochemical markers related to Alzheimer's dementia in serum and cerebrospinal fluid[J]. Neurobiol Aging, 2002, 23(4) : 485–508. DOI:10.1016/S0197-4580(01)00328-1 |
| [2] | Chen K, Kazachkov M, Yu PH. Effect of aldehydes derived from oxidative deamination and oxidative stress on beta-amyloid aggregation:pathological implications to Alzheimer's disease[J]. J Neural Transm, 2007, 114(6) : 835–839. DOI:10.1007/s00702-007-0697-5 |
| [3] | Unzeta M, Solé M, Boada M, et al. Semicarbazide-sensitive amine oxidase (SSAO) and its possible contribution to vascular damage in Alzheimer's disease[J]. J Neural Transm, 2007, 114(6) : 857–862. DOI:10.1007/s00702-007-0701-0 |
| [4] | Nakao H, Umebayashi C, Nakata M, et al. Formaldehyde-induced shrinkage of rat thymocytes[J]. J Pharmacol Sci, 2003, 91 : 83–86. DOI:10.1254/jphs.91.83 |
| [5] | Nie CL, Zhang W, Zhang D, et al. Changes in conformation of human neuronal tau during denaturation in formaldehyde solution[J]. Protein Pept Lett, 2005, 12(1) : 75–78. DOI:10.2174/0929866053405931 |
| [6] | Teng S, Beard K, Pourahmad J, et al. The formaldehyde metabolic detoxification enzyme systems and molecular cytotoxic mechanism in isolated rat hepatocytes[J]. Chem Biol Interact, 2001, 130-132(1-3) : 285–296. |
| [7] | Cantarella G, Lempereur L, D'alcamo M, et al. Trail interacts redundantly with nitric oxide in rat astrocytes:potential contribution to neuro degenerative processes[J]. Journal of Neuroimmunology, 2007, 182(1-2) : 41–47. DOI:10.1016/j.jneuroim.2006.09.007 |
| [8] | 尹蔚兰, 让欧艳, 让蔚清, 等. 较低剂量甲醛诱导人脐静脉内皮细胞损伤的时相特征及机制[J]. 实用预防医学, 2007, 14(5) : 1338–1343. |
| [9] | Atan MS, Moochhala SM, Ng KC, et al. Effects of aminoguanidine and L-arginine methyl ester resuscitation following induction of fluid-percussion injury and severe controlled hemorrhagic shock in the rat brain[J]. J Neurosurg, 2004, 101(1) : 138–144. DOI:10.3171/jns.2004.101.1.0138 |
| [10] | Boccellino M, Cuccovillo F, Napolitano M, et al. Styrene-7, 8-oxide activates a complex apoptotic response in neuronal PC12 cell line[J]. Carcinogenesis, 2003, 24(3) : 5352–5401. |
| [11] | 田婷, 毛伟平, 张超, 等. 镉致HEK293细胞凋亡中氧化应激作用[J]. 中国公共卫生, 2007, 23(10) : 1192–1193. |
| [12] | Bal-Price A, Brown GC. Nitric oxide induced necrosis and apoptosis in PC12 cells mediated by mitochrodria[J]. J Neurochem, 2000, 75(4) : 1455–1464. |
 2009, Vol. 25
2009, Vol. 25