2. 中国药品生物制品检定所细胞室
戊型肝炎(戊肝,HE)是由戊型肝炎病毒(HEV)引起的一种非甲非乙型病毒性肝炎。HE在亚洲、非洲和美洲等发展中国家人群中发病率较高,在一些地区可占到急性病毒性肝炎的50%〔1, 2〕。HEV是一种无包膜的单股正链RNA病毒,基因组全长约7.2 kb,有3个开放型读码框(ORF)。目前国际病毒分类委员会(ICTV)暂未对其进行准确分类。Lu L〔3〕等对Genbank中421个HEV的核苷酸序列进行了分析,HEV主要分为4个基因型,而且具有明显的地域性。
目前有报道, 猪、鹿、犬、鼠、马和鸡等动物体内均检测出了HEV抗体,而且从猪群中分离出的HEV与当地人群中流行的HEV同属一个基因型。因此,戊型肝炎可能为人畜共患的传染病〔4-7〕。为了解HEV在其他家畜中的流行情况,对武汉地区的小牛、羊感染HEV的情况进行了调查,了解其感染程度以及感染趋势,并将HEV核酸阳性样品接种恒河猴以观察其致病性,为控制HEV在该地区的传播和扩散提供依据。
1 材料与方法 1.1 样本采集武汉地区小牛血清样本397份和羊血清样本503份。从每头小牛和每只丰中采集约5mL血液样本,2 500 r/min离心25 min,分离血清,并放置-20 ℃保存备用。
1.2 试剂HEV抗原酶联免疫检测试剂以及双抗原夹心法检测HEV总抗体的酶联免疫检测试剂(北京万泰公司)检测猴血清中的抗一HEV IgG和IgM抗体的酶联免疫试剂(新加波MP Biomedicals Asia pacific Pte Ltd分司)。
1.3 样本血清学检测及结果判定采用HEV抗原酶联免疫检测试剂以及双抗原夹心法检测HEV总抗体的酶联免疫检测试剂,对样本进行HEV抗原以及抗HEV抗体的检测。按试剂说明书的要求进行操作并判定结果。对于HEV抗原S/CO即样品的A值比Cutoff值)值介于1~5之间的样本进行双孔复试,双孔复试均阳性者判为该样本为阳性。
1.4 核酸检测对HEV抗体或抗原检测为阳性的样本用荧光RT-PCR试剂盒(北京金豪公司)进行HEV核酸检测,按照产品说明书进行操作。对荧光RT-PCR检测为HEV核酸阳性者用套式RT-PCR方法进行扩增,其中套式方法所用的引物为HEV ORF2区的简并引物(SEEO1/I1,SEBO1/I1)〔8〕。检测方法如下:用金豪核酸抽提试剂盒提取HEV核酸,用SuperScript First-Strand Synthesis System将提取的HEY核酸逆转录合成cDNA,具体扩增方法参考文献〔8〕。
1.5 PCR产物的克隆以及序列分析取套式RT-PCR阳性产物进行电泳,从电泳胶中切出条带,并用DNA胶回收试剂(北京全式金公司)对DNA片段进行纯化回收,将纯化的产物连接到T3载体(北京全式金公司)上。然后用载体上的测序引物对插入片段进行序列测定。采用DnaStar软件对所获得的基因序列进行比对分析,并画出基因进化树。序列分析所用的ORF2参照序列分别为(括号中为GenBank号):HEV 1型的代表序列为Moro (AF065061);2型的代表序列为M1(M74506);3型的代表序列01-9913(AF466676);4a亚型的代表序列为Ch87(AJ344171),4b亚型的代表芋列为Chl81(AJ344188),4c亚型的代表序列为HE-JAl (AB097812),4d的代表序列为Tl (AJ272108),4e亚型的代表序列为:IND-SWl (AF324501),4g的亚型代表序列为CCC220(ABl08537),4f亚型的代表序列为HE-JA2(AB082558)。
1.6 HEV核酸阳性样品接种恒河猴将HEV核酸阳性样品(编号为羊107)用0.2 μm的滤器进行除菌过滤,分成1.5和1.3 mL 2份样品,其编号分别为WH1和WH2。每只猴子的体重为2 kg左右,在接种前观察2周,并检测抗-HEV IgG和抗-HEV IgM抗体及转氨酶,且HEV抗体均为阴性,转氨酶正常。接种当天留取粪便以及血清样品; 每份样品接种1只猴子。接种后每周采集1次血清以及粪便样品并现场检测血清转氨酶。对采集的血清样品进行HEV抗原、抗HEV IgG和IgM抗体和核酸的检测; 对粪便样品,用含1%BSA的生理盐水将其制成10%的悬液,进行核酸检测。
1.7 统计分析使用SPSS软件进行统计分析。
2 结果 2.1 HEV抗原和抗体检出情况 2.1.1 羊血清HEV抗原和抗体检测武汉地区标本503份羊血清,其HEV抗体阳性率为21.87%(110份),抗原阳性率为12.33%(62份); 抗原和抗体同时阳性者为2.78%(14份)。对羊血清抗体阳性者中抗体滴度分析显示, 抗体阳性中S/CO值 < 5者为80.91%, > 10者为4.55%,介于5~10者为14.55%。
在503份羊血清样品中,HEV抗原阳性者为62份, 阳性率为12.33%;其中在HEV抗体阴性的393份样品中有48份为HEY抗原阳性,阳性率为12.21%;在抗体阳性但S/CO值 < 10的105份样品中,有12份样品为HEV抗原阳性,阳性率为11.43%;在抗体阳性且S/CO值 > 10的5份样品中有2份为HEV抗原阳性,阳性率为40%。经统计分析,这3部分样本的抗原阳性水平之间差异无统计学意义。
对羊血清抗原阳性者S/CO值分布分析表明,S/CO值 > 10者为3.22%, < 5者为91.93%,介于两者之间者为4.83%。
2.1.2 小牛血清HEV抗原和抗体检测武汉地区397份小牛血清标本,HEV抗体阳性率为2.02%(8份),抗原阳性率为0%。对小牛血清抗体阳性者中抗体滴度分析显示,抗体阳性者S/CO值 > 10者为2份, < 5者为5份,介于5~10者为1份。
2.2 序列分析用荧光RT-PCR试剂对抗体阳性的8份小牛血清以及抗原或抗体阳性的158份羊血清进行HEV核酸检测,结果仅有1份羊血清为HEV核酸阳性,其编号为107。该样品的血清学检测结果为HEV抗原阴性而抗体阳性。
对该样品采用套式RT-PCR进行检测,结果亦为阳性,对其阳性产物进行克隆和测序。序列分析结果显示, 该序列与l型、2型和3型的核苷酸序列的同源性分别为75.6%, 76.7%和76.6%,与4a、4b、4c、4d、4e、4f和4g亚型的同源性分别为85.8%,84.2%,83.2%,84.8%,82.4%,87.1%和86.1%。因此,该序列与4型的同源性较高,应该为4型。基因进化树分析也显示,该序列为HEV 4型,但与已报道的各亚型有所不同。
2.3 HEV核酸阳性样品接种恒河猴(图 1)
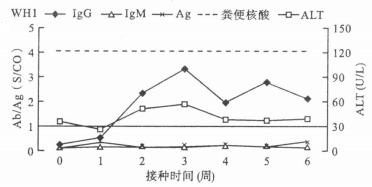
|
图 1 恒河猴WH1的HEV标志物和转氨酶的动态变化 |
将HEV核酸阳性的羊血清分别以1.3和1.5 mL各静脉接种1只恒河猴,接种后观察6周,2只猴子均未出现典型的肝炎症状,转氨酶也无明显升高; 血清和粪便中均未检测到HEV核酸; 接种1.5 mL血清样品的WHl猴子其抗-HEV IgG抗体从接种后10 d开始阳转,持续至试验观察截止时间,但其IgM抗体未阳转; 而另1只猴子其IgG和IgM抗体均未阳转。
3 讨论本研究用ELISA方法检测武汉地区小牛和羊血清中HEV抗原和抗体情况,并对抗体或抗原阳性的样本进行核酸检测。结果显示。503份羊血清中HEV抗体阳性率为21.87%,抗原阳性率12.33%;抗原和抗体同时阳性者为2.78%。而小牛血清中HEV抗体阳性率为2.02%,无抗原阳性者。由此可见,在同一地区小牛感染HEV的概率明显低于羊感染HEV的概率。但对于本地区猪的HEV感染率〔9〕,小牛和羊的感染率要明显偏低。
在羊和小牛血清中虽然有一定比例的样品为HEV抗体阳性,但其S/CO值大部分 < 10,比猪群中HEV抗体滴度普遍较低,这也可能说明猪比羊和小牛对HEV更敏感。在小牛血清中无HEV抗原阳性者,而羊血清中抗原的阳性率为12.33%,但抗原阳性者其核酸均为阴性,而在对猪血清检测时两者符合率较高,可达32%左右〔10〕。分析其原因:(1) 抗原阳性的样本中S/CO值 < 5者达到91.93%,即大部分阳性样品的S/CO值均 > 5,S/CO值 > 10者仅为3.22%,如此则不能排除有部分的样品为假阳性,至少阳性很弱; (2) 可能是由于HEV核苷酸序列变异较大,不同引物的检出情况不同,一套引物甚至简并引物也很难检出HEV的所有基因型以及亚型。因此,要提高HEV核酸检出率,可采用几种引物分别进行检测。
在所有样本中只检出了1份为HEV核酸阳性,对其核酸阳性产物的序列分析显示该序列为HEV 4型,可能为一新的亚型。将该样品进行无菌处理后接种恒河猴,结果无明显感染症状。分析其可能原因,一方面可能是因为病毒载量较低,攻毒量不够,不足以引起受试动物感染HEV,并引发肝炎临床症状。1.5 mL的攻毒量可引起抗体变化,但1.3 mL攻毒量却不足以引起抗体的变化; 另一方面,从羊中分离的HEV能否在猴体中诱发典型的肝炎症状还不确定,仍需要进一步确认。
本研究承蒙武汉三利生物技术有限公司提供样品,特此致谢!| [1] | 张军. 戊型肝炎研究动态:第12届国际病毒性肝炎和肝病研讨会(巴黎)信息[J]. 国际病毒学杂志, 2006, 13(4) : 97–100. |
| [2] | 董红军, 热西达, 阿农古厢, 等. 新疆哈萨克族病毒肝炎感染状况调查[J]. 中国公共卫生, 1995, 11(1) : 10–12. |
| [3] | Lu L, Li C, Hagedorn CH. Phylogenetic analysis of global hepatitis E virus sequences:genetic diversity, subtypes and zoonosis[J]. Rev Med Virol, 2006, 16(1) : 5–36. DOI:10.1002/(ISSN)1099-1654 |
| [4] | Meng XJ. Swine hepatitis E virus:cross-species infection and risk in xenotransplantation[J]. Curr Topmerobiol Immunol, 2003, 278 : 185–216. |
| [5] | Magdi DS, Hussein A, Hussein, et al. Hepatitis E virus infection in work horses in Egypt[J]. Infection, Genetics and Evolution, 2007, 7 : 368–373. DOI:10.1016/j.meegid.2006.07.007 |
| [6] | Tamada Y, Yano K, Yatsuhashi H, et al. Consumption of wild boar linked to cases of hepatitis E[J]. Hepatol, 2004, 40 : 869–870. DOI:10.1016/j.jhep.2003.12.026 |
| [7] | Tei S, Kitajima N, Takahashi K, et al. Zoonotic transmission of hepatitis E virus from deer to human beings[J]. Lancet, 2003, 362 : 371–373. DOI:10.1016/S0140-6736(03)14025-1 |
| [8] | Wang YC, Zhang HY, Xia NS, et al. Prevalence, isolation, and partial sequence analysis of hepatitis E virus from domestic animals in China[J]. Med Viro1, 2002, 67 : 516–521. DOI:10.1002/(ISSN)1096-9071 |
| [9] | 刘小桂, 李秀季, 陈平, 等. 湖北地区出口猪及不同人群中戊型肝炎病毒感染调查研究[J]. 中国国境卫生检疫杂志, 2007, 30(5) : 273–277. |
| [10] | Li XJ, Zhao CY, Harrison TJ, et al. Investigation of hepatitis E virus infection in swine from Hunan province, China[J]. Jourfnal of Medical Virology, 2008, 80(8) : 1391–1396. DOI:10.1002/(ISSN)1096-9071 |
 2009, Vol. 25
2009, Vol. 25

