2. 中国疾病预防控制中心传染病预防控制所;
3. 天津医科大学基础医学院
大肠埃希菌是尿路感染的主要致病菌,85%以上的菌株具有P菌毛,P菌毛能特异性地粘附、定植于人泌尿道上皮细胞,进而引起尿道上行性感染,这类菌株称为尿道致病性大肠埃希菌(Uropathogenic E.coli,UPEC)〔1〕。P菌毛包括2种蛋白, 其中P菌毛尖端PapG粘附素是UPEC粘附定植的关键因子,人类特有的PapG依其受体结合特异性不同分为Ⅰ、Ⅱ 2种血清型; Ⅰ、Ⅱ型PapG粘附能力不同,因此,其菌株致病性也有差别〔2〕。另1种蛋白是PapA (或称F抗原,P fimbrial Antigen),占P菌毛蛋白总量的99.9%;PapA是UPEC血清学分型的基础,现共发现11个血清型,与血清型相对应的是11个基因型〔3〕。对于UPEC菌株的papG和papA 2个基因型的流行病学研究国外已有报道〔2-4〕。本研究应用papG和papA多重PCR基因分型方法〔3-5〕对国内分离的45株UPEC进行papG和papA基因分型,以期明确国内UPEC P菌毛的papG和papA的基因型分布状况及两者可能的组合形式,为UPEC的致病机制、遗传变异、流行病学分析和免疫防治等的研究提供基础依据。
1 材料与方法 1.1 材料(1) 菌株、质粒和培养基:分离自江苏省无锡市第二人民医院、天津医科大学总医院和第二医院、北京协和医院1992~2006年尿路感染者尿标本尿道致病性大肠埃希菌(UPEC)45株,均经常规细菌学方法鉴定,再经D-甘露糖抵抗血凝反应(MRHA)和papC PCR法双重鉴定确定为带有P菌毛菌株。(2) 标准菌株:UPEC132,其P菌毛papA和papG分别为F13型和Ⅱ型; UPECJ96为F13型和Ⅰ型papG代表株; UPEC1442为F12型papA代表株; E.coli k-12p678-54为无菌毛代表株(美国Hull RA和de Ree JM教授惠赠)。(3) 质粒:pPIL110-75、pPIL110-37、pANN921、pPIL288-10、pF-10、pPIL291-15、pCT10、pF14、pF15和pF16(美国Hull RA和de Ree JM教授惠赠),分别带有血清型为F7-1、F7-2、F8、F9、F10、F11、F13、F14、F15和F16的UPEC菌株染色体上编码P菌毛的粘附基因群〔3〕。(2)试剂和仪器:脂质双层(LB)固体和液体培养基(北京博大泰克公司); DNA提取设备为genomic DNA isolation kit (北京博大泰克公司),PCR引物由上海Sangon公司合成; DNA标准分子量(大连TaKaRa公司); PE2400DNA扩增仪(美国GE公司)。
1.2 方法 1.2.1 papG多重PCR扩增(1) 根据文献〔4〕合成用于papG基因分型的2对寡核苷酸引物分别对应于该基因的5′和3′端,预期扩增papGⅠ、Ⅱ型基因中461,190bp片段。引物序列为:Ⅰ型上游:5′-TCGTGCTCAGGTCCGGAATTT-3′,下游:5′-TGGCATCCCCCAACATTATCG-3′; Ⅱ型上游:5′-GGGATGAGCGGGCCTTTGAT-3′,下游:5′-CGGGCCCCCAAGTAACTCG-3′。(2) 反应体系与反应条件如下:10×扩增缓冲液5 μl, MgCl2 2 mmol/L混合4种脱氧核糖核苷酸(dNTP)200 μmol/L, 混合4种引物各20 pmol, 模板DNA 10 ng加双蒸水(DDW)至50 μl, 混合后加入TaqDNA聚合酶2 U。预变性95 ℃ 7 min; 94 ℃ 1 min, 61 ℃ 1 min, 72 ℃ 1 min 3个循环; 91 ℃ 1 min, 63 ℃ 1 min, 72 ℃ 1 min 25个循环; 72 ℃延伸10 min。
1.2.2 papA多重PCR扩增(1) 根据文献〔3〕合成13条寡核苷酸引物,其中F7-1r、F7-2r、F8r、F9r、F10r、F11r、F12r、F13r、F14r、F15r、F12/15r、F16r分别代表11个不同基因型papA下游引物,Ff为上游共有引物,预期扩增375,183,251,416,312,277,393,400,320,455,179,239bp片段,其中F12r和F12/15r为扩增F12型UPEC papA基因片段的3′端共同引物。引物序列如下:上游引物Ff:5′-GGCAGTGGTGTCTTTTGGTG-3′; 下游引物F7-1r:5′-TTTCACCCGTTTTCCACTCG-3′,产物375bp; F7-2r:5′-TTTGGGTTGACTTTCCCCATC-3′,产物183bp; F8r:5′-GTACCACCTACAGCACTTGG-3′,产物251bp; F9r:5′-AAGGCCCCGTTGACGTTTT-3′,产物416bp; F10r:5′-CTCCTCATTATGACCAGAAACCCT-3′,产物312bp; F11r:5′-GGCCCAGTAAAAGATAATTGAACC-3′,产物277bp; F12r:5′-CCCATCGACAAGACTTGACA-3′,产物393bp; F13r:5′-GGGTATTAGCATCACCTTCGGAG-3′,产物400bp; F14r:5′-GCAGCATATCTTTATTGTTCCC-3′,产物320bp; F15r:5′-GCTACATTCTTGCCACTTGC-3′,产物455bp; F12/15r:5′-AATTCTTGGGCGTTGAGGATCCA-3′,产物179bp; F16r:5′-GTTCCCGCTTTATTACCAGC,产物239。为了扩增片段在电泳胶上易于分辩,将上游通用引物与12条下游引物的PCR反应分为poolA (Ff+F11r, F14r, F13r, F15r)、poolB (Ff+F12/15r, F8r, F7-1r, F9r)、poolC (Ff+F7-2r, F16r, F10r, F12r)3个组。(2) 反应体系与反应条件如下:10×扩增缓冲液5 μl, MgCl2 3mmol/L混合4种dNTP200 μmol/L, pool A、B、C内5种引物各20 pmol,模板DNA (质粒DNA/细菌染色体DNA),加DDW至50 μl,混合加入TaqDNA聚合酶4 u。预变性94 ℃ 10 min; 94 ℃ 1 min, 62 ℃ 1 min, 72 ℃ 1 min 10sec 3个循环; 94 ℃ 1 min, 67 ℃ 1 min, 72 ℃ 1.5 min 25个循环; 72 ℃延伸10 min。
2 结果 2.1 papG基因片段多重PCR扩增结果(图 1)
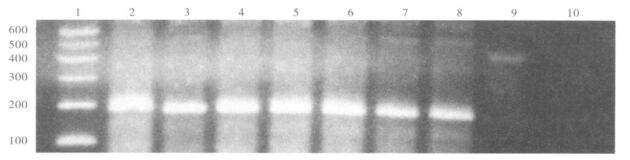
|
注:1:DNA Marker; 2~7:UPEC4119,UPEC1200,UPEC134,UPEC4030,UPECSH2, UPEC102;8:UPEC132;9:UPECJ96;10:E.coli k-12p678-54。 图 1 UPEC菌株papG PCR扩增后琼脂糖凝胶电泳(2%) |
Ⅰ、Ⅱ型papG阳性对照菌株UPECJ96、UPEC132扩增出预期约461,190 bp特异性产物; 无菌毛阴性对照菌株E.coli k-12 p678-54经同样操作未被扩增。45株UPEC分离株papG扩增产物全部为papGⅡ型,扩增阳性率为100%。
2.2 papA多重PCR基因分型结果 2.2.1 papA基因型标准质粒和代表菌株(图 2)
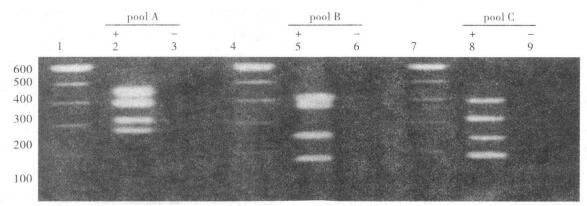
|
注:M:DNA Marker; poolA:320bp (F14), 400bp (F13);poolB:251bp (F8),416bp (F9) poolC:(-)。 图 2 标准质粒与F12菌株papA多重PCR扩增后琼脂糖凝胶电泳(2%) |
10个papA基因型标准质粒和F12菌株分属3个papA基因分型PCR组,经多重PCR扩增,均获得papA基因分型预期的特异性扩增产物。
2.2.2 45株UPEC菌株(图 3)
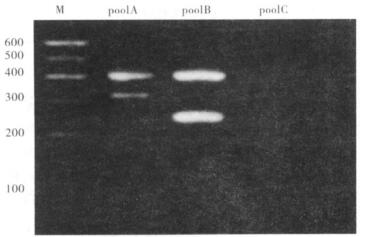
|
注:1,4,7:DNA Marker; 3,6,9:E.colik-12p678-54;2:pPIL291-15(F11)、pF14(F14)、pCT10(F13)、pF15(F15);5:UPEC1442和pF15(F12/15)、pANN921(F8)、pPIL110-75(F7-1)、pPIL288-10(F9);8:pPIL110-37(F7-2)、pF16(F16)、pF-10(F10)、UPEC1442(F12)。 图 3 UPEC106菌株papA多重PCR扩增后琼脂糖凝胶电泳(2%) |
45株UPEC papA多重PCR基因分型扩增阳性率为97.8%(44/45株),仅有1株(UPEC4030)经同样操作, 3组多重PCR扩增没有结果。44株papA阳性菌株中,11个基因型分布如下:具有单一基因型24株, 54.55%;具有2个基因型13株, 29.55%;具有3个基因型4株, 9.09%;具有4个基因型3株, 6.82%,均为F8+F9+F13+F14。44株UPEC papA阳性菌株中,含F10和F13各12株, 27.27%;F7-2和F11各11株,25.00%;F14 10株,22.72%;F16 9株,20.45%;F8、F9和F15各3株,6.82%;F7-1、F12为0株; 按基因型出现频次计算,F10和F13最多,12株; 其余依次为F7-2和F11,11株; F14为10株; F16为9,为国内UPEC的优势基因型; F7-2、F16、F10、F11、F13和F15可以以单一基因型出现,尤其F7-2未发现有联合出现血清型的菌株; F8,F9,F10,F11,F13,F14常与其他基因型联合出现。
3 讨论本研究结果显示,国内分离的45株UPEC菌株其基因分型均为Ⅱ型papG。国外研究发现,自Ⅰ型标准株UPECJ96分离鉴定以来,也仅发现8株UPECⅠ型菌株,其papG与papA的组合形式皆为Ⅰ型papG与F13型papA〔3〕。在本试验中,可能由于本研究所用菌株数目相对较少,没有检出Ⅰ型papG菌株的存在,如扩大样本量是否会检出UPECJ96样的Ⅰ型菌株,尚需进一步探讨。
本研究结果还显示,45株UPEC菌株进行papA多重PCR基因分型,44例出现阳性结果其中单一基因型为F7-2,F11,F16,与国外报道相一致〔3, 5〕,优势血清型为F13,F7-2,F10,F11,F14,F16,与国外报道F7-2,F10,F11有差别〔3, 5, 6〕。具有4个基因型的UPEC菌株(F8+F9+F13+F14)在国内外尚未见报道。国外已有Ⅰ型papG+F13型papA和Ⅱ型papG+F7-2, F10, F11, F16型papA组合形式的报道,但仅仅是对少量UPEC菌株的单一研究结果〔3-5〕。对45株UPEC菌株进行总体研究表明,国内UPEC菌株尚有Ⅱ型PapG+F8,F9,F13,F14,F15papA组合形式,国外未见这些组合形式的报道。UPEC106,UPEC238等菌株同时具有F8、F9、F13、F14等4个基因型,与Ⅱ型papG的组合形式属首次发现。致病岛(PAI)最早是用来描述UPEC染色体上2个分子量很大、编码许多毒力相关基因的不稳定的外源DNA片段。已有报道,3株UPEC (536、J96和CFT073)的12个PAIs〔6-8〕。UPEC的粘附基因群提示其必有PAI存在。以上结果提示,国内UPEC菌株的流行病学信息、遗传变异特点及其致病岛与国外菌株存在不同之处,了解国内菌株的特点和演变规律,将有助于UPEC的毒力、致病机制及其防治研究的深入。
本研究结果提示,国内分离的UPEC菌株papG高度保守,而papA呈现高度多态性,其流行病学信息和遗传变异特点与国外菌株存在很大不同之处,且可能有不同于国外的未知papA基因型的UPEC菌株存在。
| [1] | Struve C, Krogfeld KA. In vivo detection of Escherichia coli type 1 fimbrial expression and phase variation during experimental urinary tract infection[J]. Microbiology, 1999, 145 : 2683–2690. DOI:10.1099/00221287-145-10-2683 |
| [2] | Girón JA, Torres AG, Freer E, et al. The flagella of enteropathogenic Escherichia coli mediate adherence to epithelial cells[J]. Mol Microbiol, 2002, 44 : 361–379. DOI:10.1046/j.1365-2958.2002.02899.x |
| [3] | Johnson JR, Stell AL, Scheutz F, et al. Analysis of the F antigen-specific papA alleles of extraintestinal pathogenic Escherichia coli using a novel multiplex PCR-based assay[J]. Infect Immun, 2000, 68(3) : 1587–1599. DOI:10.1128/IAI.68.3.1587-1599.2000 |
| [4] | Johnson JR, Brown JJ. A novel multiply primed polymerase chain reaction assay for indentification of variant PapG genes encoding the gal (α1-4) Gal-binding PapG adhesins of Escherichia coli[J]. J Infect Dis, 1996, 173 : 920–926. DOI:10.1093/infdis/173.4.920 |
| [5] | Johnson JR, Stell AL, Kaster N, et al. Novel molecular variants of allele I of the Escherichia coli P fimbrial adhesin gene papG[J]. Infect Immun, 2001, 69 : 2318–2327. DOI:10.1128/IAI.69.4.2318-2327.2001 |
| [6] | Lane MC, Simms AN, Mobley HL, et al. Complex interplay between Type 1 fimbrial expression and flagellum-mediated motility of uropathogenic Escherichia coli[J]. J Bacteriol, 2007, 189 : 5523–5533. DOI:10.1128/JB.00434-07 |
| [7] | Hagan EC, Mobley LT. Uropathogenic Escherichia coli outer membrane antigens expressed during urinary tract infection[J]. Infect Immun, 2007, 75 : 3941–3949. DOI:10.1128/IAI.00337-07 |
| [8] | 徐建国. 分子细菌学[M]. 北京: 科学出版社, 2000: 197-200. |
 2009, Vol. 25
2009, Vol. 25
