巨噬细胞的吞噬功能是宿主对外源化学物早期关键应答〔1〕。腹腔巨噬细胞吞噬鸡红细胞试验,是一种广泛应用于检测非特异性免疫功能的传统方法,主要评价指标为吞噬百分率和吞噬指数〔2〕。由于近年来对于动物保护的重视和对“3R”原则-“Reduction (减少)”、“Replacement (替代)”、“Refinement (优化)”的倡导〔3〕,各国研究人员均在进行替代试验方法的研究。腹腔巨噬细胞吞噬乳胶颗粒的试验作为一种替代方法,与传统方法比较可以减少鸡红细胞的使用,并且操作程序简单,结果判读准确。为进一步完善该方法的实验条件,本研究观察不了不同培养条件和目前常用的4种品系小鼠对腹腔巨噬细胞吞噬乳胶颗粒的百分率和吞噬指数的影响,旨在为标准化实验方法提供依据。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雌性Balb/c小鼠,体重20~22 g,10只、C57小鼠(20~22 g)5只、ICR小鼠体重22~24 g,5只、KM小鼠体重22~24 g,5只[北京大学医学部实验动物科学部,许可证号:SCXK (京)2006-2008]。在对不同培养条件对小鼠腹腔巨噬细胞吞噬功能影响的试验中,除品系对腹腔巨噬细胞吞噬乳胶颗粒百分率的影响使用4种品系的小鼠外,其余比较均使用Balb/c小鼠。
1.1.2 主要试剂与仪器乳胶颗粒(美国Sigma公司); RPMI (Roswell, Park Memorial institute)1640培养液(美国Gibco公司); 小牛血清(北京元亨金马生物技术有限公司)。CO2培养箱(德国Herus cell公司); 超净工作台(北京昌平长城空气净化工程公司)。
1.2 方法 1.2.1 小鼠腹腔巨噬细胞的制备脱臼处死小鼠,将3 mL小牛血清浓度为5%的RPMI 1640完全培养液注入小鼠腹腔,轻揉腹部。打开腹腔吸取腹腔液,1%冰醋酸计数细胞后用培养液调整细胞浓度为1×106/mL。将细胞液放入24孔板中,0.5 mL/孔,37 ℃、5% CO2培养箱中孵育2 h,待细胞贴壁后弃上清,用无血清的冷RPMI 1640冲洗掉未贴壁的细胞〔4〕。
1.2.2 条件筛选(1) 培养时间:将处理后的细胞在37 ℃、5%CO2培养箱分别培养0.5,1,2,4 h后终止试验。(2) 小牛血清浓度:加入不同小牛血清浓度的RPMI 1640培养液(2.5%,5%,10%)0.5 mL,乳胶颗粒浓度为1‰,于37 ℃、5% CO2培养箱中培养2 h中止试验。(3) 乳胶颗粒浓度:在细胞已贴壁的24孔板中加入含乳胶颗粒浓度分别为0.25‰,0.5‰,1‰,2‰的RPMI1640培养液各0.5 mL,于37 ℃、5% CO2培养箱中培养2 h后中止试验。(4) 贴壁与否:不经贴壁处理的细胞直接在含1‰乳胶颗粒的RPMI1640完全培养液中培养2 h后中止实验。贴壁组经贴壁2h后置于含1‰乳胶颗粒的RPMI1620完全培养液中培养2 h后中止试验。(5) 品系:不同品系小鼠腹腔巨噬细胞贴壁后,每孔加入含1‰的乳胶颗粒培养液0.5 mL,培养2 h后中止实验。以上除观察不同小牛血清含量对小鼠腹腔巨噬细胞吞噬百分率和指数影响外,其他试验中RPMI 1640培养液的小牛血清含量为5%。采用荧光显微镜下计数细胞吞噬百分率和吞噬指数评价最优条件。(6) 荧光显微镜计数:在荧光显微镜下观察并拍照。每个样品(孔)至少拍照5个不同视野,以保证有足够的细胞用于计数。荧光的激发波长为485 nm,发射波长为530 nm。吞噬百分率(PP)=(吞噬乳胶颗粒的巨噬细胞数/巨噬细胞总数)×100%;吞噬指数(PI)=(吞噬乳胶颗粒的总数/巨噬细胞总数)×100%。
1.3 统计分析采用SPSS 13.0统计软件进行t检验。
2 结果 2.1 培养时间对吞噬指标影响随着培养时间延长,腹腔巨噬细胞的吞噬百分率逐渐增加,分别为(42.00±9.43)%,(63.40±4.10)%,(82.00±1.87)%和(89.60±1.82)%,各个培养时间段吞噬百分率差异均有统计学意义(P < 0.05)。
2.2 小牛血清浓度对吞噬指标影响随着小牛血清浓度升高,巨噬细胞吞噬百分率及吞噬指数均有所上升。2.5%,5%,10%的小牛血清浓度下其吞噬百分数分别为(77.83±4.71)%,(79.17±4.31)%和(84.00±3.74%); 吞噬指数分别为(3.01±0.79)%,(3.32±0.52)%和(3.79±0.60)%。除含2.5%与10%小牛血清培养液培养的腹腔巨噬细胞相比较其吞噬百分率差异有统计学意义(P < 0.05);其余各浓度培养液培养的腹腔巨噬细胞吞噬百分率或吞噬指数之间差异均无统计学意义。
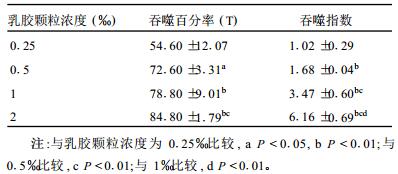
2.3 乳胶颗粒浓度对吞噬指标影响(表 1,图 1)| 表 1 乳胶颗粒浓度对小鼠腹腔巨噬细胞吞噬百分率的影响(x±s) |

|
注: A:乳胶颗粒浓度为0.25‰; B:乳胶颗粒浓度为0.5‰; C:乳胶颗粒浓度为1‰; D:乳胶颗粒浓度为2‰。 图 1 腹腔巨噬细胞吞噬不同浓度乳胶颗粒图(× 400) |
随着乳胶颗粒浓度的增加腹腔巨噬细胞吞噬百分率逐渐升高。Balb/c小鼠腹腔巨噬细胞在乳胶颗浓度为1‰和0.5‰时以及2%和1%时的吞噬百分率比较,差异均无统计学意义; 其余各组吞噬百分率和吞噬指数比较,差异均有统计学意义(P < 0.01或P < 0.05)。
2.4 贴壁与否对吞噬指标影响未经贴壁处理的腹腔巨噬细胞与乳胶颗粒直接混合后培养2 h,其对乳胶颗粒的吞噬百分率和吞噬指数明显低于先经贴壁处理2 h的细胞,吞噬百分率分别为(70.33±4.41)%和(79.17±4.31)%; 吞噬指数分别为(1.67±0.24)%和(3.31±0.52)%,差异均有统计学意义(P < 0.01)。
2.5 品系对吞噬指标影响Balb/c、ICR、C57和KM种小鼠腹腔巨噬细胞吞噬百分率分别为(79.00±6.47)%,(57.60±9.34)%,(60.40±7.16)%,(57.00±2.55)%; 吞噬指数分别为(3.39±0.54),(1.06±0.20),(1.29±0.11),(1.09±0.15)。Balb/c小鼠巨噬细胞的吞噬百分率和吞噬指数均高于其他3个品系小鼠,差异均有统计学意义(P < 0.01)。ICR、C57和KM种小鼠腹腔巨噬细胞吞噬百分率和吞噬指数比较,差异均无统计学意义。
3 讨论本研究结果显示,随着培养时间的延长,吞噬百分率逐渐升高,但2与4 h吞噬百分率上升曲线斜率已明显趋于平缓,因此,可认为贴壁后培养2 h,能较敏感反映巨噬细胞吞噬百分率的变化。培养液中血清含量为2.5%~5%时,镜下观察细胞生长状态较好,可满足本实验需要。乳胶颗粒浓度为1‰,易洗掉未被吞噬的乳胶颗粒,背景较为清晰,吞噬乳胶颗粒均易判读,利于显微镜下计数。同时较低浓度的血清和乳胶颗粒可以降低实验成本。经贴壁处理后,Balb/c小鼠巨噬细胞吞噬百分率和吞噬指数均有显著提高,提示贴壁处理可提高腹腔巨噬细胞吞噬乳胶颗粒的灵敏度。通过对不同品系小鼠腹腔巨噬细胞吞噬百分率和吞噬指数研究发现,Balb/c小鼠的腹腔巨噬细胞吞噬百分率最高。正是Balb/c小鼠遗传背景的一致性、个性差异的稳定性和实验中表现出的敏感性,使其一直被作为免疫功能评价试验的首选动物。对小鼠腹腔巨噬细胞吞噬百分率的评价,Balb/c小鼠也是最佳的选择。根据以上研究初步确定最佳的实验条件为:选用Balb/c小鼠,乳胶颗粒浓度为1%、小牛血清浓度为2.5%~5%、细胞贴壁2 h后吞噬培养2 h为最佳实验条件。
| [1] | Liu GW, Ma HX, Wu Y, et al. The nonosonic allogeneic cell phagocytosis of macrophages detected by flow cytometry and two photon fluorescence microscope[J]. Transphant Immunology, 2006, 16 : 220–226. DOI:10.1016/j.trim.2006.09.023 |
| [2] | 薛彬. 免疫毒理学实验技术[M]. 北京: 北京医科大学-中国协和医科大学联合出版社, 1995: 53-54. |
| [3] | Andrew Worth M B.Alternative (non-animal) methods for chemical testing:current status and future prospects[R].Italy:Ecvam and the Ecvam working group on chemicals, 2002, 3-6. |
| [4] | 魏雪涛, 尚兰琴, 蒋建军, 等. 五氯酚钠急性染毒对小鼠免疫细胞损伤影响[J]. 中国公共卫生, 2007, 23(5) : 597–599. |
| [5] | 黄琼, 李志, 杨杏芬, 等. 流式细胞术检测小鼠腹腔巨噬细胞吞噬功能[J]. 中国药理学与毒理学杂志, 2007, 21(2) : 140–146. |
 2009, Vol. 25
2009, Vol. 25