甲苯二异氰酸酯(toluene diisocyanate, TDI)是合成聚氨酯的主要原料,工业上广泛用于氨基甲酸泡沫胶、合成橡胶、油漆、涂料、塑料等的生产。长期接触和使用,可对人体的呼吸系统、免疫系统、生殖系统等造成损害。已有研究证实,TDI对动物有致癌作用,为人类的可疑致癌物〔1〕。国际癌症研究机构(IARC)体外实验显示,TDI可引起人淋巴细胞DNA损伤和染色体畸变,啮齿动物细胞基因突变和姐妹染色单体交换〔2〕。DNA损伤是导致基因突变发生的一个必不可少的前提。DNA交联作为一种重要的DNA损伤,在细胞内大量存在可以干扰细胞正常的复制转录过程,从而导致肿瘤或某些严重疾病的发生〔3〕。本研究以中国仓鼠肺细胞(CHL)为靶细胞,探讨甲苯二异氰酸酯(TDI)对细胞内DNA的交联作用,揭示其遗传毒性,为评价TDI类化合物潜在的生物学效应提供科学依据。
1 对象与方法 1.1 仪器与试剂MC-20AIC型CO2恒温培养箱(日本SANYO公司); SW-CJ-2F型生物洁净工作台(苏州安泰空气技术有限公司); 荧光分光光度计RF-540(日本岛津Shimazu公司)。PRMI-640培养基(美国Gibco公司); 小牛血清(上海纬群生物技术有限公司); 乙二胺四乙酸(EDTA)、三羟甲基氨基甲烷(TRIS)、十二烷基硫酸钠(SDS)、蛋白酶K、Hoechst 33258、小牛胸腺DNA (美国Sigma公司); 其他试剂如氯化钾(KCl)、二甲基亚砜(DMSO)等均为国产分析纯。甲苯二异氰酸酯(TDI,分析纯,美国Sigma公司); 中国仓鼠肺细胞(CHL,中国协和医科大学基础所细胞室)。
1.2 细胞处理将处于对数生长期的CHL细胞(105~106)接种于培养瓶中,培养24 h后,加入不同浓度的TDI,终浓度分别为0.64,1.28,2.56 μmol/mL,同时设溶剂对照组(DMSO)和紫外线照射阳性对照组; 继续培养2 h,消化离心收集细胞。
1.3 DNA-DNA交联(DDC)的检测〔4〕 1.3.1 细胞裂解在制备好的细胞悬液中加入0.5 mL SDS (2%)溶液,轻微振荡,65 ℃水浴中加热10 min,待用。
1.3.2 游离DNA、DDC与DNA-蛋白质交联(DPC)的分离在上述待测样品中加入100 μl的1.0 mol/L的KCl (pH 7.5),将混合液6次穿过1 mL的聚丙烯枪头,冰上冷冻5 min后,SDSK+沉淀(包括蛋白质和DPC形成,4 ℃ 10 000 r/min离心5 min,收集沉淀,将上清(DNA、DDC)转入另一5 mL离心管中。
1.3.3 DPC中结合DNA的分离将上述沉淀重悬浮于0.5 mL的清洗缓冲液(KCl 0.1 μmol/L,EDTA 0.1 mmol/L, Tris-HCl 20 mmol/L,pH 7.5)中,加入0.5 mL的蛋白酶(0.4 mg/mL),50 ℃水浴消化3 h,冰上骤冷5 min,4 ℃ 12 000 r/min离心10 min,收集上清液,将上清液转入上述5 mL离心管中。再向沉淀中加入1 mL的清洗缓冲液重悬,65 ℃水浴中加热10 min,冰上骤冷5 min,4 ℃ 10 000 r/min离心5 min,收集沉淀,重复清洗步骤3次,每次都将上清转入上述5 mL离心管中。
1.3.4 游离DNA变性将上述5 mL离心管中的上清液混匀后,各取1 mL分装2管作为待测样品,一管在100℃水浴中加热5 min进行热变性,随后快速冷却至23 ℃,使其中游离的DNA变性后不致复性。
1.3.5 染色与检测向上述待测样品中加入1 mL新鲜配制的400 ng/mL的荧光染料Hoechst33258, 使终浓度为200 ng/mL,置于暗处30 min,用荧光分光光计在353 nm激发光和455 nm发射光下测得其荧光值,按下式计算DNA-DNA交联率。
DNA-DNA交联率:Ct=(fn-f0)/(1-f0)。式中Ct为DNA-DNA交联率,fn为染毒组中热变性后的荧光强度/热变性前的荧光强度,f0为对照组中热变性后的荧光强度/热变性前的荧光强度。
1.4 DPC的检测〔5〕 1.4.1 细胞裂解在染毒后的细胞沉淀中分别加入0.5 mL SDS (2%)溶液,轻微振荡,65℃水浴中加热10 min,裂解细胞。
1.4.2 游离DNA的分离从水浴取出裂解好的细胞,加入1.0 mol/L KCl (pH 7.5)溶于20 mmol/L Tris-HCl中100 μl,将混合液6次穿过1 mL的聚丙烯枪头,从而使DNA长度统一。混合液冰上冷冻5 min,形成SDS-K+沉淀,4 ℃ 10 000 r/min离心5 min,收集沉淀,将上清液转入另一5 mL离心管中。沉淀加1 mL清洗缓冲液重悬,65 ℃水浴加热10 min,冰上骤冷5 min,重复离心和清洗步骤3次,每次都将上清液转入5 mL离心管中。
1.4.3 DPC中结合DNA的分离最终的沉淀重悬于0.5 mL的清洗缓冲液中,然后加入0.5 mL的蛋白酶K (0.4 mg/mL),50 ℃水浴中消化3 h,再在冰上骤冷5 min,然后于4 ℃12 000 r/min离心10 min,收集上清液即为DPC中的DNA。
1.4.4 DPC的定量制作DNA浓度的标准曲线,用清洗缓冲液配制终浓度为0,100,300,500,750,1 000,1 500,2 000,3 000,5 000 ng/mL的小牛胸腺DNA标准液,然后加入1 mL新鲜配制的400 ng/mL荧光染料Hoechst33258,使荧光染料的终浓度为200 ng/mL,置于暗处染色30 min,用荧光分光光度计在350 nm激发光和450 nm发射光下测得各浓度的荧光值,制备标准曲线。将上述待测样品用同样方法染色,测定其荧光值,根据DNA标准曲线来定量DPC中DNA (A)和原液中DNA (B)的含量,按下式计算DPC系数:η=A/A+B×100%。
1.5 统计分析应用SPSS 13.0软件进行分析。
2 结果 2.1 甲苯二异氰酸酯致CHL细胞DNA-DNA交联(DDC)效应(图 1)
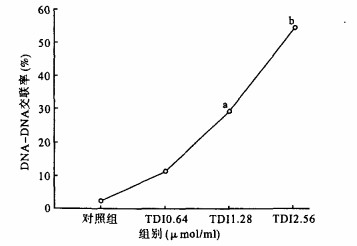
|
注:与对照组比较,a p < 0.05,b p < 0.01。 图 1 TDI诱导cHL细胞DDC效应 |
随着TDI浓度增高,染毒组细胞DNA-DNA交联率增加。0.64 μmol/LmL TDI染毒组,CHL细胞DNA-DNA交联率与对照组比较差异无统计学意义(P>0.05);当浓度上升至1.28 μmol/mL时,DNA-DNA交联率明显上升,与对照组比较差异有统计学意义(P < 0.05);浓度升高至2.56 μmol/mL时,DNA-DNA交联率为54.79%,与对照组比较差异有统计学意义(P < 0.01),表明TDI在低浓度时不能引起DNA-DNA交联,在较高浓度时,能够明显地诱导DDC的形成,并且浓度与DNA-DNA交联率之间存在剂量-效应关系。
2.2 甲苯二异氰酸酯致CHL细胞DNA-蛋白质交联(DPC)效应(图 2)
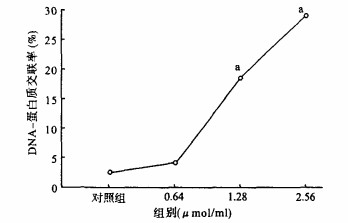
|
注:与对照组比较,a p < 0.01。 图 2 TDI诱导CHL细胞DPC效应 |
图 2显示,经0.64 μmol/mL TDI染毒处理的CHL细胞,DPC系数与对照组比较差异无统计学意义(P>0.05);但是,当浓度上升至1.28和2.56 μmol/mL时,DPC系数明显上升,且与对照组比较差异有统计学意义(P < 0.01)。表明TDI在低浓度时,不会引起DNA-A蛋白质交联; 在较高浓度时,能够明显地诱导DPC的生成。
3 讨论DNA交联包括DNA-DNA交联(DDC)和DNA-蛋白质交联(DPC)2种,是外来化学物作用于DNA所致的重要遗传损伤形式。与其他类型DNA损伤相比,DNA交联较难修复或易于发生易错修复,在细胞周期中维持时间较长,导致染色体断裂、缺失,基因突变和细胞的死亡〔6〕。
本研究结果表明,低浓度的TDI (0.64 μmol/L)不能致DNA-DNA交联(DDC)率和DNA-蛋白质交联(DPC)率发生明显变化(P>0.05);随着染毒浓度的增加(1.28,2.56 μmol/mL),其DDC交联率和DPC交联率也随之升高,可导致明显的DDC效应(P < 0.01)和DPC效应(P < 0.01)。提示一定剂量的TDI能诱导细胞内DNA交联。Peel M等研究发现,经TDI处理的DNA形状与对照不同,且复性后14%DNA发生重构〔7〕,与本实验结果相似。
随着人们生活水平的提高,各种涂料已成为美化环境不可缺少的装饰材料,大量聚氨酯油漆、防水涂料、聚氨酯密封的使用,使TDI成为室内主要空气污染物之一。因此,应加强环境空气监测和作业人群健康监护,降低和限制各种装饰材料中游离TDI含量,避免长期接触对机体健康造成危害。
| [1] | Bilban M. Mutagenic testing of workers exposed to toluene-diisocyanates during plastics production process[J]. Am J Ind Med, 2004, 45(5) : 468–474. DOI:10.1002/(ISSN)1097-0274 |
| [2] | Sabbioni G. Monographs on the evaluation of the carcinogenic risk of chemicals to humans[M].Lyon: IARC Press, 1999: 865-879. |
| [3] | Shaham J, Bomstein Y, Gurvich R, et al. DNA-protein crosslinks and p53 protein expression in relation to occupational exposure to formaldehyde[J]. Occup Environ Med, 2003, 60(6) : 403–409. DOI:10.1136/oem.60.6.403 |
| [4] | Liu YS, Lu ZS, Chang ML, et al. Studies on formation and repair of formaldehyde-damaged DNA by detection of DNA-protein crosslinks and DNA breaks[J]. Frontiers in Bioscience, 2006, 11 : 991–997. DOI:10.2741/1856 |
| [5] | Zhitkovich A, Costa M. A simple sensitive assay to detect DNA-protein crosslinks in intact cells and vivo[J]. Carcinogenesis, 1992, 13(8) : 1485–1489. DOI:10.1093/carcin/13.8.1485 |
| [6] | Merk O, Reiser K, Speit G, et al. Analysis of chromate induced DNA-protein crosslinks with comet assay[J]. Mutation Research, 2000, 47(1) : 71–80. |
| [7] | Peel M, Marczynski B, Baur X. Comparison of the binding potential of various diisocyanates on DNA in vitro[J]. J Toxicol Environ Health, 1997, 52(6) : 517–526. DOI:10.1080/00984109708984078 |
 2009, Vol. 25
2009, Vol. 25

