2. 四川大学华西公共卫生学院
枳实(Citrus aurantium,ZhiShi)为芸香科植物酸橙(Citrus aurantium L)及其栽培变种或甜橙的干燥幼果,是临床常用中药〔1〕,也可用于保健食品。经高效液相色谱(HPLC)测定,枳实中含柚皮苷、橙皮苷、新橙皮苷等类黄酮,且含量较高。研究表明,枳实提取物具有较强的体外抗氧化作用〔2〕。近年来,抗氧化能力降低在诱发糖尿病并发症方面日益受到重视,氧化应激带来的脏器损伤可能是糖尿病多种并发症发病机制的共同通道〔3, 4〕。国内外对芸香科植物中黄酮类物质的抗氧化作用进行了较多研究〔5〕,而有关枳实的体内抗氧化作用研究报道较少。本研究旨在探讨枳实提取物对糖尿病小鼠肾脏抗氧化能力的影响及胰岛细胞保护作用,为减轻糖尿病并发症和开发枳实资源提供科学依据。
1 材料与方法 1.1 材料 1.1.1 枳实购买自成都荷花池中药材市场,经鉴定为酸橙幼果。
1.1.2 实验动物80只屏障级雄性昆明种小鼠(四川省医科院动物所,合格证号:医动字第24101106号),体重为17~20 g。其中10只用于正常对照组,70只用于糖尿病小鼠模型的建立,得到40只糖尿病模型小鼠。
1.1.3 主要仪器与试剂GT-1640型血糖仪(日本ARKRAY公司); 722紫外可见光分光光度计(江苏扬中绿扬分析仪器厂); 恒温水浴锅(江苏省金坛市医疗仪器厂); 5810R冷冻型高速离心机(德国EPPENDORF公司); Olympus BX60荧光正置显微镜(日本OLYMPUS公司)。GLUCOCARDTM Test StripⅡ血糖试纸(批号:77502,美国LIFESCAN公司); 链脲佐菌素(德国MERK公司); 丙二醛(MDA)、NO、谷胱甘肽(GSH)含量,超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、一氧化氮合酶(NOS)活性以及组织蛋白含量的测定试剂盒(南京建成生物研究所)。
1.2 方法 1.2.1 枳实提取物的制备参照文献〔2〕。
1.2.2 糖尿病模型小鼠的建立雄性昆明种小鼠,常规饲料适应性饲养1周后,腹腔注射链脲佐菌素(STZ),72 h后再加强注射1次,每次80 mg/(kg·bw),正常组注射等量的柠檬酸缓冲液。加强注射后的第4 d,测空腹血糖,禁食3~5 h、尾静脉全血血糖≥11.1 mmol/L〔6〕的小鼠判定为糖尿病成功动物模型。
1.2.3 动物分组及处理40只成模糖尿病小鼠按血糖随机分为:糖尿病模型组(DM)组、枳实低(ZL)、中(ZM)、高剂量(ZH)组,同时设正常对照(NC)组,每组10只。低、中、高剂量组动物分别按每千克体重1.69,3.37,5.07 g枳实提取物灌胃。对照组和糖尿病组以0.4 ml蒸馏水灌胃,各组均每日灌胃1次,共4周。整个实验过程中均在独立通风笼系统动物房喂养,糖尿病组小鼠自由进食高脂饲料(常规饲料加10%猪油)和饮水,正常组自由进食常规饲料和饮水,室温20~24 ℃,湿度60%~70%,12 h/12 h明暗周期。
1.2.4 观察指标及测定方法试验过程中每周称体重,血糖水平用葡萄糖试纸检测。在第4周末,称重,断颈处死动物,取肾脏称重, 测定肾脏指数(肾脏重量/小鼠体重)。称取适量肾组织,加冷生理盐水,在冰浴条件下,制成10%的组织匀浆,低温低速离心,取上清液。SOD活性采用黄嘌呤氧化酶法测定,CAT活性采用紫外分光光度法测定,GPx活性和GSH含量采用二硫代二硝基苯甲酸比色法测定。NO含量和NOS活性采用硝酸还原酶比色法测定,MDA含量采用硫代巴比妥酸(TBA)缩合法测定,组织蛋白含量采用考马斯亮兰法测定。具体测定方法参照试剂盒说明书。
1.2.5 组织学检查留取胰腺标本,甲醛固定,常规石蜡包埋、切片、苏木素-伊红(HE)染色,显微镜观察。
1.3 统计分析应用SPSS 11.5统计软件进行独立样本t检验。
2 结果 2.1 枳实提取物成分总黄酮含量为(0.699±0.008) g/g。经HPLC测定,枳实提取物中柚皮苷为21.15%、橙皮苷为1.09%、新橙皮苷为19.10%、芦丁为0.02%、槲皮素为0.04%。
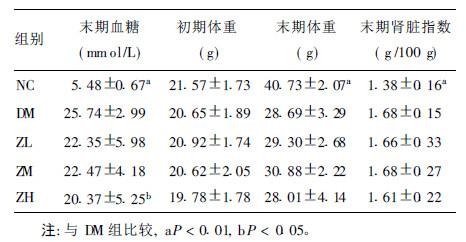
2.2 血糖、体重及肾脏系数比较(表 1)| 表 1 各组小鼠一般情况比较(x±s) |
喂养初期各组小鼠体重差异无统计学意义,末期DM组小鼠体重低于NC组(P < 0.01),提示糖尿病对小鼠生长可能有抑制作用。试验末期,DM组小鼠血糖高于NC组(P < 0.01),ZH组血糖低于DM组(P < 0.05),提示高剂量枳实具有降低血糖的作用。DM组末期肾脏指数高于NC组(P < 0.01),枳实各剂量组与DM组之间差异无统计学意义。
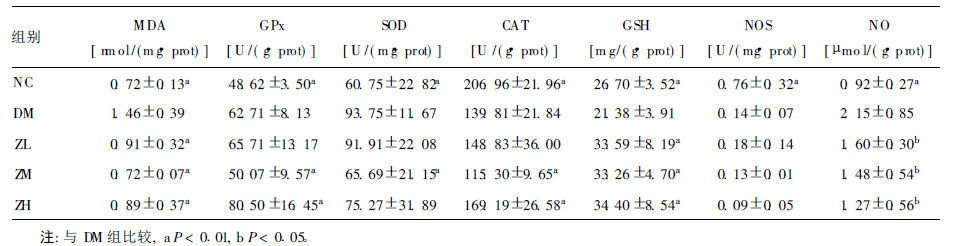
2.3 各组小鼠肾脏氧化应激情况(表 2)| 表 2 各组小鼠肾脏氧化应激情况(x±s) |
试验末期,DM组小鼠肾脏组织中GPx、SOD活性、MDA和NO含量均明显高于NC组,CAT、NOS活性和GSH含量均明显低于NC组(P < 0.01)。与DM组比较,ZL、ZM、ZH组小鼠肾脏MDA和NO含量均明显下降,GSH含量均明显升高(P < 0.01或P < 0.05);ZH组GPx、CAT活性均明显升高(P < 0.01);ZM组GPx、CAT、SOD活性均明显降低(P < 0.01);NOS活性差异无统计学意义。
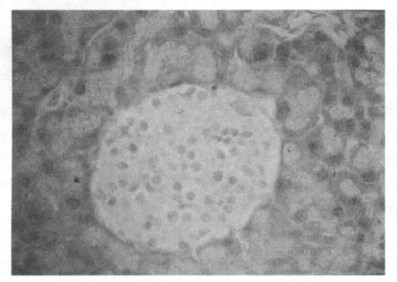
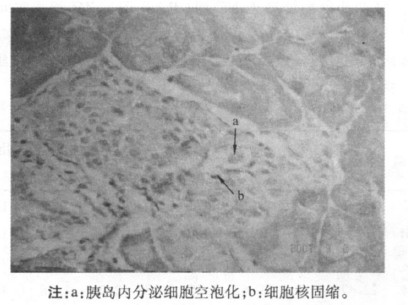
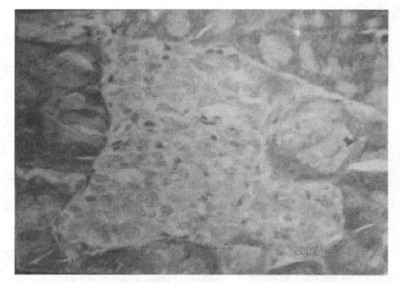
2.4 胰岛形态学检查光镜下正常小鼠(NC组)胰岛形态无异常,呈椭圆形,大小不一,散在分布于外分泌组织之间,胰岛内分泌细胞均匀分布,细胞呈圆形,大小较均匀,核居细胞中央,见图 1。糖尿病小鼠(DM组)胰岛体积明显缩小、数量明显减少,形态不规则,内分泌细胞空泡化明显,部分细胞核固缩、核消失明显,细胞间隙增大,见图 2。与DM组相比,ZL组胰岛体积变小,数量减少,胰岛细胞空泡化及核固缩等变化程度与DM组相似; ZM组胰岛体积变小、数量减少,胰岛细胞空泡化等较DM组减轻; ZH组半数(5/10)动物胰岛内分泌细胞损伤较DM组明显减轻,见图 3。
|
图 1 正常小鼠胰岛组织形态(×400) |
|
图 2 糖尿病小鼠胰岛组织形态(×400) |
|
图 3 枳实高剂量治疗组(×400) |
3 讨论
研究表明,氧化应激存在于糖尿病发病过程中〔7, 8〕, 随着高血糖的持续,组织中自由基增加〔9〕,产生活性氧自由基(ROS)引起组织损伤。这种损伤作用主要是通过自由基对体内的脱氧核糖核酸、蛋白质和脂肪的氧化修饰实现,并因此导致后期的糖尿病并发症〔10〕。本试验测定肾脏指数,DM组明显高于NC组,可能是由于糖尿病小鼠高血糖导致产生应激,肾脏代偿性增大〔7〕。研究还发现,DM组小鼠肾组织与NC组比较,CAT、NOS活性和GSH含量明显降低,GPx、SOD活性、MDA和NO含量明显升高,表明糖尿病小鼠处于抗氧化防御机能低下状态。给予枳实提取物治疗后,与DM组比较,小鼠MDA、NO含量明显降低,GSH含量明显升高,CAT活性明显升高,表明枳实提取物能提高糖尿病小鼠肾脏抗氧化酶活性,抑制脂质过氧化反应,对糖尿病小鼠抗氧化防御功能具有一定的恢复作用,胰腺组织切片光镜观察可见,糖尿病小鼠胰岛细胞受到损伤。高剂量枳实能保护胰岛细胞免受损伤,同时还具有降低血糖的作用。关于其降糖机制有待于进一步研究。
| [1] | 田代华. 实用中药词典[M]. 北京: 人民卫生出版社, 2002: 1341. |
| [2] | 焦士蓉, 马力, 黄承钰, 等. 枳实提取物的体外抗氧化作用研究[J]. 中药材, 2008, 31(1) : 113–116. |
| [3] | 牟忠卿, 陈丽, 傅艺凌, 等. 糖尿病大鼠肾脏组织中氧化应激的实验研究[J]. 中国老年学杂志, 2005, 25(3) : 303–305. |
| [4] | Vincent AM, Brownlee M, Russell JW. Oxidative stress and programmed cell death in diabetic neuropathy[J]. Ann N Y Acad Sci, 2002, 959 : 368–383. DOI:10.1111/j.1749-6632.2002.tb02108.x |
| [5] | Jeon SM, Bok SH, Jang MK, et al. Antioxidative activity of naringin and lovastatin in high cholesterol-fed rabbits[J]. Life Sciences, 2001, 69 : 2855–2866. DOI:10.1016/S0024-3205(01)01363-7 |
| [6] | 杨润军, 李青旺, 赵蕊. 四氧嘧啶与链脲佐菌素诱导小鼠糖尿病模型的效果比较[J]. 西北农林科技大学学报, 2006, 32(2) : 17–19. |
| [7] | Lapshina EA, Sudnikovich EJ, Maksimchik JZ, et al. Antioxidative enzyme and glutathione S-transferase activities in diabetic rats exposed to long-term ASA treatment[J]. Life Sciences, 2006, 79 : 1804–1811. DOI:10.1016/j.lfs.2006.06.008 |
| [8] | 贾文波, 许继取, 宋方方, 等. 2型糖尿病患者胰岛素抵抗和氧化应激反应[J]. 中国公共卫生, 2006, 22(7) : 769–771. |
| [9] | Anwar MM, Meki AR. Oxidative stress in streptozotocin-induced diabetic rats:effects of garlic oil and melatonin[J]. Comparative biochemistry and physiology Molecular and Integrative Physiology, 2003, 135 : 539–547. DOI:10.1016/S1095-6433(03)00114-4 |
| [10] | Baydas G, Canatan H, Turkoglu A. Comparative analyses of protective effects of melatonin and vitamin E on streptozotocin-induced diabetes mellitus[J]. Journal of Pineal Research, 2002, 32 : 225–229. DOI:10.1111/jpi.2002.32.issue-4 |
 2009, Vol. 25
2009, Vol. 25