磺胺类药物是一类广泛使用的预防性和刺激动物生长(常作饲料添加剂)的抗生素,其在动物源性食品中的残留对人类健康的潜在危害日趋严重,被受到广泛关注。进行动物源性食品磺胺类残留分析具有重要意义〔1〕。由于动物源食品基质复杂,在进行残留分析时通常需要对样品提取液进行净化,目前报道的净化技术主要有液液萃取、固相萃取、基质分散固相萃取〔2-5〕等方法。凝胶渗透色谱(GPC)方法作为一种通用的样品净化技术已经成功应用于农药的多残留分析〔6〕,但应用于药物的多残留分析报道很少〔7〕。为了探讨GPC净化技术应用于动物源食品中药物残留分析的效果,本研究应用GPC净化技术结合高效液相色谱法(HPLC)检测了动物源食品中9种磺胺类药物残留量,取得较为满意的结果。现报告如下。
1 材料与方法 1.1 仪器与试剂(1)仪器:Beckman 125高效液相色谱仪(HPLC)带二极管阵列检测器(美国Beckman公司); Accuprepp凝胶渗透色谱仪(美国J2 Scientific公司); SIGMA 2-5K离心机,组织匀浆机,UPW-25超纯水系统,EYEAL旋转蒸发仪,中压玻璃层析柱(15 mm×500 mm,上海楚柏实验设备公司); 吹氮浓缩仪,超声波清洗器,Pharmadex LH-20葡聚糖凝胶(英国Amersham Biosciences公司)。(2)试剂:甲醇、三氟乙酸、乙腈、乙酸乙酯、二氯甲烷,均为HPLC级; 无水硫酸钠,分析纯; 水为超纯水。(3)磺胺类药物标准品:磺胺嘧啶、磺胺吡啶、磺胺甲嘧啶、磺胺二甲嘧啶、磺胺噻唑、磺胺甲噻唑、磺胺氯哒嗪、磺胺异恶唑、磺胺甲恶唑等9种标准品,纯度≥99.0%(美国Sigma公司)。
1.2 方法 1.2.1 样品提取液制备用市售鸭肉样品经粉碎、混匀后,准确称取5.00 g样品,加入盛有5 g左右无水硫酸钠的离心管,搅匀,使样品成疏松状,加入乙酸乙酯35 ml,置于组织匀浆机于10 000 r/min匀浆5 min,于超声波清洗器超声10 min,于3 500 r/min离心5 min,分离后的残渣再用15 ml乙酸乙酯提取1次,合并2次提取液,于旋转蒸发仪浓缩至干,残渣用5.0 ml二氯甲烷-甲醇溶解,经0.45 μm滤膜过滤,该提取液供进一步净化用。
1.2.2 LH-20凝胶渗透色谱柱制备称取15 g LH-20葡聚糖凝胶浸泡在70 ml二氯甲烷-甲醇(1:1,V/V,下同)溶液过夜,吸涨后的凝胶仍保持在液面下。将吸涨的凝胶转移到中压玻璃层析柱内,用二氯甲烷-甲醇作淋洗剂,在重力作用下流经凝胶柱,填充至450 mm高度,稳定后两端压紧。将制好的凝胶柱装于凝胶色谱仪上,以二氯甲烷-甲醇作为流动相,以2.0 ml/min流速冲柱30 min,稳定后待用。
1.2.3 凝胶渗透色谱洗脱净化使用Accuprepp凝胶渗透色谱仪进行净化。凝胶色谱条件:采用自制的LH-20凝胶色谱柱; 以二氯甲烷-甲醇(1:1,V/V)为流动相; 流速2.0 ml/min; 进样量2.5 ml; 检测波长270 nm。弃去前20 min的洗脱液,收集20~40 min洗脱液,收集液置于旋转蒸发仪浓缩至干,残渣用2.0 ml流动相溶解,经0.45 μm滤膜过滤供高效液相色谱分析。
1.2.4 HPLC分析及色谱条件Agilent TC-C18反相色谱柱(4.6 mm×250 mm,粒径5 μm); 流动相A为0.1%三氟乙酸水溶液,流动相B为0.1%三氟乙酸乙腈溶液。B液梯度洗脱程序:5%保持1 min,然后以1.5% min速度升至11%,保持5 min,再以1%/min速度升至25%,最后回到初始条件,2次进样之间平衡15 min。流速1.5 ml/min; 柱温35 ℃; 紫外检测波长270 nm; 进样量:100 μl。
1.2.5 标准系列及样品回收试验(1)标准溶液系列:准确称取每种磺胺标准品各10mg,用甲醇溶解并定容至10.0 ml,配制成1.00 mg/ml的各种磺胺标准储备液。分别取贮备液各1.00 ml于10 ml容量瓶,用甲醇定容,该溶液为9种磺胺混合标准溶液(100 mg/L),再用流动相配制成浓度分别为0.050,0.10,0.50,1.0,5.0 mg/L的标准系列。标准系列与样品溶液各进样100 μl,记录峰面积,以峰面积对浓度作标准曲线,外标法定量。以相关系数(r)分析线性关系,根据信噪比S/N=3计算检测限(LOD),S/N=10计算定量(LOQ)。(2)回收率和精密度试验:空白鸭肉样品分别添加0.10,0.25 mg/kg的磺胺药物标准溶液,摇匀,使标准溶液被样品充分吸收,然后按照样品前处理方法进行提取和净化,高效液相色谱测定,回收率(%)及相对标准偏差(RSD, %)实验各浓度均重复测定3次。
2 结果 2.1 样品提取剂磺胺类药物为白色或微黄色结晶性粉末,难溶于水,较易溶于稀释、稀碱和有机溶剂。因此选用乙酸乙酯作为样品的提取剂; 乙酸乙酯难溶于水,提取时较难渗入样品内部,故加入无水硫酸钠,使样品成疏松状,可更好地进行回收。
2.2 LH20凝胶柱洗脱净化效果取空白鸭肉样品的乙酸乙酯提取物作为基质组分,试验了9种磺胺药物及基质组分在LH-20葡聚糖凝胶柱上的流出时间。结果显示,基质组分洗脱液流出时间为10~17 min,9种磺胺类药物洗脱液流出时间为20~40 min,9种磺胺药物均与基质组分得到很好分离,达到净化效果。因此,在GPC净化时选择收集20~40 min的流出液,弃去其余部分。
2.3 乙腈-0.1%三氟乙酸梯度洗脱效果(图 1)

|
注:1:磺胺嘧啶; 2:磺胺吡啶; 3:磺胺噻唑; 4:磺胺甲嘧啶; 5:磺胺二甲嘧啶; 6:磺胺甲噻唑; 7:磺胺氯哒嗪; 8:磺胺甲恶唑; 9:磺胺异恶唑。 图 1 9种磺胺类药物混合标准溶液(0.5mg/L)色谱图 |
经过对梯度洗脱程序进行优化,选定合适的梯度洗脱时间程序。图 1可见,在选定的HPLC色谱条件下,9种磺胺在药物峰形及分离良好。
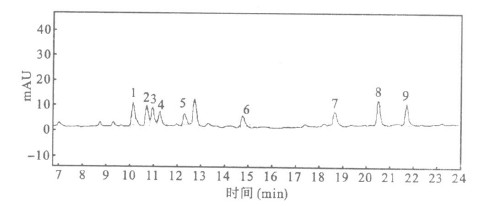
2.4 鸭肉加标样品HPLC分析(图 2)
|
注:1:磺胺嘧啶; 2:磺胺吡啶; 3:磺胺噻唑; 4:磺胺甲嘧啶; 5:磺胺二甲嘧啶; 6:磺胺甲噻唑; 7:磺胺氯哒嗪; 8:磺胺甲恶唑; 9:磺胺异恶唑。 图 2 加标鸭肉样品(加标浓度:0.25mg/kg)经GPC净化后的HPLC色谱图 |
图 2可见,经GPC净化的加标样品,可以得到9种磺胺类药物分离较为清晰的色谱图。
2.5 线性关系和检测限取9种磺胺混合标准溶液,按配置的标准系列,以选定的色谱条件进行测定,以峰面积Y对浓度X (mg/L)进行线性回归。9种磺胺药物均具有良好的线性关系,相关系数(r)均在0.999 8~0.999 9;检测限为4.6~8.0 μg/kg,定量限为15~27 μg/kg。
2.6 精密度和回收率(表 1)| 表 1 鸭肉中磺胺类药物不同加标水平回收率和精密度实验结果(n=3) |
表 1可见,9种磺胺类药物回收率为70.3%~84.7%,相对标准偏差为1.6%~5.8%。回收率较高,相对标准偏差低,方法的重现性较好。
3 小结GPC净化技术主要是基于分子大小的原理进行分离的,它具有重现性好,回收率高,适用于多残留分析等特点。本实验结果表明,GPC-HPLC法测定动物源食品中9种磺胺类药物残留,由于前处理使用GPC,可以除去大部分干扰物的影响,与其他方法相比,本方法具有快速、灵敏、准确的特点。
| [1] | 甘宾宾, 杨玉霞, 唐健, 等. 动物性食品中抗生素和激素残留污染及检测[J]. 中国公共卫生, 2006, 22(8) : 1014–1015. |
| [2] | 张艳, 吴银良. 固相萃取-高效液相色谱法测定动物肉组织中磺胺类药物的残留[J]. 色谱, 2005, 23(6) : 636–638. |
| [3] | 刘桂华, 刘红河, 毛丽莎, 等. 鸡蛋中代谢物液相色谱-串联质谱联用测定[J]. 中国公共卫生, 2007, 23(12) : 1492–1493. |
| [4] | 万春花, 龙洲雄, 胡海山, 等. RP-HPLC法同时测定动物组织中十五种磺胺类药物残留[J]. 食品科学, 2007, 28(10) : 493–496. |
| [5] | 耿志明, 李鹏, 陈明, 等. 基质固相分散-高效液相色谱法测定鱼肉中磺胺类药物残留[J]. 江苏农业学报, 2006, 22(3) : 310–312. |
| [6] | Pang GF, Cao YZ, Zhang JJ, et al. Validation study on 660 pesticide residues in animal tissues by gel permeation chromatography cleanup/gas chromatography-mass spectrometry and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2006, 1125(1) : 1–30. DOI:10.1016/j.chroma.2006.05.023 |
| [7] | Roybal JE, Pfenning AP, Turnipseed SB, et al. Application of size-exclusion chromatography to the analysis of shrimp for sulfonamide residues[J]. Analytica Chimica Acta, 2003, 483(1-2) : 147–152. DOI:10.1016/S0003-2670(02)01488-5 |
 2009, Vol. 25
2009, Vol. 25

