传统的微生物学检验技术能够分离出猪链球菌, 但很容易同时分离出其他种的链球菌, 近些年来应用的几种分离技术方法通常既费时又费力, 而且敏感性不高〔1〕。为了更好地预防猪链球菌病的发生, 有效控制病原菌的传播与流行, 必须建立快速、敏感且特异的诊断方法。猪链球菌2型是流行最广、致病性最强的猪链球菌血清型〔2〕。同时,16S rRNA基因是猪链球菌种特异基因〔3〕,荚膜多糖编码基因cps2J是猪链球菌2型特异基因〔4〕。因此,本研究根据GenBank中报道的猪链球菌种特异基因16S rRNA基因序列和猪链球菌2型特异性荚膜多糖编码基因cps2J基因序列,设计和合成2对特异引物,通过对反应条件和体系进行优化,建立猪链球菌2型多重PCR检测方法。
1 材料与方法 1.1 材料(1)猪链球菌2型菌株:共18株,其中分离自花都医院患者3株(2007SF0165, 2006SF0140, 2006SF0146,广州市疾病预防控制中心保存),分离自病猪14株(华南农业大学),猪链球菌2型参考菌株1株(98HAH33,达安生物有限公司惠赠); (2)其他菌株:溶血性链球菌CMCC32210,鼠伤寒沙门菌CMCC50115,金黄色葡萄球菌ATCC25923,大肠埃希菌ATCC25922, 变形杆菌CMCC49005,副溶血性弧菌ATCC4750等(均为本室保存)。
1.2 方法 1.2.1 菌株培养和模板DNA提取将菌株复苏后接种于相应的增菌培养基培养18~24 h然后转种至血平板培养18~24 h, 在平板上挑取2~3个单个菌落与100 μl灭菌纯水研磨混匀,95 ℃ 10 min, 10 000 r/min离心5 min, 取上清作为DNA模板。
1.2.2 多重PCR引物设计与合成根据GenBank中报道的猪链球菌种特异基因16S rRNA序列(Genbank accession No.NC 009443 SSU98_0578)和猪链球菌2型特异性荚膜多糖编码基因cps2J基因序列(Genbank accession No.NC 009443 SSU98_0818),运用Primer 5.0设计2对特异引物,16S rRNA上游引物:5′-cagtatttaccgcatggtagatat-3′, 下游引物:5′-gtaagataccgtcaagtgagaa-3′, 扩增片段为300 bp左右,cps2J上游引物:5′-gttgagtccttatacacctgtt-3′,下游引物:5′-cagaaaattcatattgtccacc-3′,扩增片段为450 bp左右,引物由上海生工公司合成。
1.2.3 多重PCR扩增及条件优化分别采用单一引物,对扩增相应目的基因片段进行PCR扩增条件摸索, 然后进行多重PCR扩增条件筛选及优化。最后采用多重PCR扩增的条件:50 μl PCR反应体系中,含10×PCR反应缓冲液5.0 μl, 25 mmol/L MgCl 23.0 μl, 10 mmol/L dNTP 1.0 μl, 16S rRNA上游引物(25 pmol/μl) 1.0 μl, 16S rRNA下游引物(25 pmol/μl)1.0 μl, cps2J上游引物(25 pmol/μl) 1.0 μl, cps2J下游引物(25 pmol/μl) 1.0 μl, 模板DNA 5.0 μl, Taq酶(5 U/μl) 0.6 μl, 灭菌双蒸水补足至总体积50 μl。将PCR反应体系置于PCR热循环仪上, 94 ℃ 5 min; 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 60 s共30个循环。最后, 72 ℃延伸10 min。
1.2.4 PCR扩增产物电泳检测取5 μl PCR产物和1 μl 6×上样缓冲液充分混匀置2.0%琼脂糖凝胶(含溴化乙锭替代物Goldview)电泳。电压5 V/cm, 电流40 mA, 电泳缓冲液0.5×三羟甲基氨基甲烷-硼酸盐-乙二胺四乙酸(TBE)。凝胶成像仪观察结果并拍照。
1.2.5 敏感性试验猪链球菌血平板培养基37 ℃培养18~24 h后,刮取菌落用灭菌双蒸水配成1个麦氏浓度菌悬液, 再以灭菌双蒸水对猪链球菌株进行10倍连续稀释, 得到100~108 cfu/ ml的浓度, 从各浓度度中取5 μl进行多重PCR分析, 评价其敏感性。
2 结果 2.1 单一引物PCR扩增(图 1,图 2)
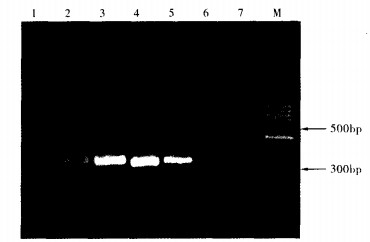
|
注:M:100 bp marker; 1:溶血性链球菌; 2:200 7SF0 165;3:2006SF0140;4:2006SF0146;5:98HAH33;6:鼠伤寒沙门菌; 7:金黄色葡萄球菌。 图 1 16S rRNA PCR扩增 |
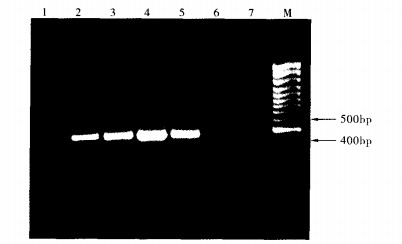
|
注:M:100 bp marker; 1:溶血性链球菌; 2:2007SF0165;3:2006SF0140;4:2006SF0146;5:98HAH33;6:鼠伤寒沙门菌; 7:金黄色葡萄球菌。 图 2 cps2J PCR扩增 |
16S rRNA基因片段引物均能扩增出18株猪链球菌2型, 产物大小约为300 bp左右, 而在同一条件下扩增的溶血性链球菌、鼠伤寒沙门菌、金黄色葡萄球菌、大肠埃希菌、变形杆菌、副溶血性弧菌等均未扩增出目的片段。cps2J基因同样在18株猪链球菌2型中能扩增出450 bp左右的目的片段, 而同时参与扩增的溶血性链球菌、鼠伤寒沙门菌、金黄色葡萄球菌、大肠埃希菌、变形杆菌、副溶血性弧菌等均未见目的片段。表明所设计的PCR引物的扩增结果特异性很高。
2.2 多重PCR扩增(图 3)
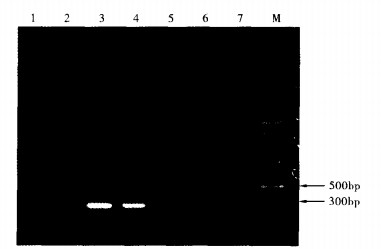
|
注:M:100 bp marker; 1:溶血性链球菌; 2:2007SF0165;3:2006SF0140;4:2006SF0146;5:98HAH33;6:鼠伤寒沙门菌; 7:金黄色葡萄球菌。 图 3 16S rRNA与cps2J多重PCR扩增 |
多重PCR均能扩增出18株猪链球菌2型。图 3可见, 4株猪链球菌2型均扩增出300 bp左右的16S rRNA基因片段和450 bp左右的cps2J基因片段, 溶血性链球菌、鼠伤寒沙门菌、金黄色葡萄球菌, 都未扩增出任何目的片段, 表明此方法用于猪链球菌2型的快速鉴定特异性较高。
2.3 多重PCR敏感性PCR在所作的稀释度中, 10 cfu/ ml以上均很好的扩增出了目的条带, 敏感性较高。
3 讨论由猪链球菌引发的猪链球菌病是全球性公共卫生问题, 在世界许多国家均有报道, 并引起广泛流行〔5〕。目前PCR技术在病原菌的检测与诊断方面被广泛应用。本研究设计的多重PCR反应体系共有2对引物, 在一个反应体系里有4条引物, 而多重PCR并非单一引物对PCR的简单组合〔6〕。在进行条件摸索时发现, Mg2+、dNTPs、酶的用量以及循环条件等均需进行优化, 尤其是DNA链退火温度。适当提高Mg2+、dNTPs的浓度, 能取得较好效果, 酶的用量与单独扩增相似时, 效果已很理想, 量不宜过大, 否则会出现拖带和非特异扩增。本文结果表明, 该特异多重PCR方法简便、快速, 同时特异性和敏感性也良好, 并且仪器试剂成本低, 技术容易掌握, 适合基层单位应用。
| [1] | Gottschalk M, Lacouture S, Odierno L. Immunomagnetic isolation of Streptococcus suis serotypes 2 and 1/2 from swine tonsils[J]. J Clin Microbial, 1999, 37(24) : 2877–2881. |
| [2] | Jobin MC, Brassard J, Quessy S, et al. Acquisition of host plasmin activity by the swine pathogen Streptococcus suis serotype 2[J]. Infection and Immunity, 2004, 72(1) : 606–610. DOI:10.1128/IAI.72.1.606-610.2004 |
| [3] | Marois C, Bougeard S, Gottschalk M. Multiplex PCR assay for detection of Streptococcus suis species and serotypes 2 and 1/2 in tonsils of live and dead pigs[J]. J Clin Microbial, 2004, 42(7) : 3169–3175. DOI:10.1128/JCM.42.7.3169-3175.2004 |
| [4] | Smith HE, Damman M, Vander Velde J, et al. Identification and characterization of the cps locus of Streptococcus suis serotype 2:the capsule protects against phagocytosis and is an important virulence factor[J]. Infect Immun, 1999, 67(4) : 1750–1756. |
| [5] | Okwumabua O, Chinnapapakkagari S. Identification of the gene encoding a 38-kilodalton immunogenic and protective antigen of Streptococcus suis[J]. Clinical and Diagnostic Laboratory Immunology, 2005, 12(4) : 484–490. |
| [6] | 胡玉山, 王鸣, 杜琳, 等. 副溶血性弧菌流行群特异多重PCR鉴定[J]. 中国公共卫生, 2007, 23(5) : 581–582. |
 2009, Vol. 25
2009, Vol. 25
