急性肺损伤(acute lung injury, ALI)是全身炎症导致多器官功能障碍综合征的肺部表现,其严重阶段即为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)。研究表明,在ALI/ARDS的发生发展中,免疫细胞功能紊乱和免疫炎性因子失衡在致病过程中作用显著〔1〕。叶黄素是一种类胡萝卜素,主要以全反式异构体形式存在于自然界海洋动物体、藻体及多数陆生植物体(如菊花、酸浆)内并具有多种生物学功能,其中尤以抗氧化、防止心血管疾病、提高免疫力和抗癌作用突出〔2〕。本实验旨在通过叶黄素对脂多糖诱导小鼠急性肺损伤模型进行研究,揭示其对此类损伤潜在的预防保护作用。
1 材料与方法 1.1 材料 1.1.1 试剂与仪器叶黄素乳化颗粒(瑞士罗氏DMS公司); 脂多糖、地塞米松(美国SIGMA公司); 异硫氰酸荧光素(FITC)标记的抗大鼠CD3单克隆抗体、PE标记的抗大鼠CD4和CD8单克隆抗体(美国Caltag公司); 小鼠肿瘤坏死因子α(TNF-α) ELISA试剂盒(武汉博士德公司); 小鼠白细胞介素8(IL-8)、白细胞介素10(IL-10) ELISA试剂盒(美国RB公司); 丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、考马斯亮蓝蛋白测定试剂盒及髓过氧化酶(MPO)测定试剂盒(南京建成生物工程公司)。Labconco冰冻真空干燥仪(法国乐高公司); 752分光光度计(中国伯乐公司); 960型荧光分光光度计、J2-SH高速冰冻离心机(均为日本岛津公司); C30柱(YMC Carotenoid S-5,美国Waters公司); 高效液相色谱(HPLC,美国Waters公司); 600E溶剂输送系统,PDA-2996二极管阵列检测器(美国Waters公司); 叶黄素乳化颗粒(瑞士罗氏DMS公司)。
1.1.2 叶黄素制备称取10 g叶黄素乳化颗粒加入少许水,加入300 ml丙酮-正己烷萃取。静置2 h后,将脂溶性相收集。再利用减压旋转蒸发仪进行提取液浓缩处理。(1)装柱:将活化好的氧化铝装填于玻璃层析柱中,正己烷润湿。(2)洗脱:分别取2 ml叶黄素提取液上柱,用50 ml正己烷-丙酮淋洗,收集洗脱液。氮气吹干制粉,装入充满氮气的玻璃瓶内,-70 ℃储存备用。
1.1.3 叶黄素鉴定参照全反式叶黄素标准品,根据高效液相色谱(HPLC)中保留时间和紫外可见吸收光谱的特征峰进行鉴定。得到的叶黄素提取液经过过滤后用高效液相色谱分离。色谱条件:色谱柱:Waters YMC Carotenoid S-5(4.6 mm×250 mm); 流动相A:乙腈-甲醇(75:25);流动相B:MTBE; 流动相A与B中分别加入0.05%三乙胺作为改性剂防止叶黄素降解; 线性梯度洗脱:B在8 min内由0增加至55%;8~35 min B维持55%;35~40 min B由55%减至0;流速:1.0 ml/min; 检测波长:λ/nm=475;波长范围260~700 nm; 进样量:20 μl。并收集后观察其光谱特征峰行为。结果表明,实验所用灌胃物为全反式叶黄素,纯度为95%。
1.2 方法 1.2.1 LPS诱导动物ALI模型的建立实验小鼠60只(中国军事医学科学院实验动物养殖中心); 按体重随机分为6组:正常对照组、急性肺损伤(ALI)模型组、地塞米松阳性对照组(5 mg/kg)以及叶黄素10,15,20 mg/kg 3个剂量组,每组10只。叶黄素组动物每天给予不同剂量的叶黄素,其他组均给予等量的食用色拉油,连续灌胃30 d,每周称体重1次,根据体重调整灌胃量。30 d后,叶黄素各剂量组、ALI模型组、地塞米松组小鼠分别腹腔注射细菌脂多糖(LPS)6.0 mg/kg,建立实验动物ALI模型,正常对照组小鼠腹腔注射生理盐水。造模6 h后,股动脉放血处死,结扎右肺,暴露气管进行气管插管,用生理盐水1.5 ml分3次进行支气管肺泡灌洗,收集支气管肺泡灌洗液(BALF),取BALF离心后上清2 ml冷冻干燥成干粉; 并收集小鼠腹主动脉血。
1.2.2 肺脏检测(1)肺湿重/干重比测定:各组小鼠开胸取全部左肺,称取湿重,60 ℃烘烤48 h,称取干重,计算肺组织湿重/干重比(即W/D)。(2)肺组织相关因子检测:取肺组织匀浆液,采用酶联免疫吸附法测定各组小鼠肺组织中肿瘤坏死因子α(TNF-α)、白细胞介素10(IL-10)含量,按试剂盒说明书测定中性粒细胞髓过氧化物酶(MPO)。
1.2.3 动脉血T淋巴细胞亚群CD3+,CD4+和CD8+检测采集小鼠腹主动脉血2.0 ml,EDTA抗凝后分别取60 μl加入2个流式细胞仪检测专用试管中。具体操作参照文献〔3〕。
1.2.4 动脉血抗氧化指标检测经3 000 r/min离心10 min,分离血清,测定各组血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)水平。MDA含量测定采用硫代巴比妥酸(TBA)比色法; SOD活性测定采用亚硝酸盐法; GSH-Px活性测定采用5,5-双硫代对硝基苯甲酸(DTNB)显色法。
1.2.5 TNF-α和IL-8检测生理盐水300 μl溶解BALF干粉,分别用TNF-α和IL-8酶联免疫试剂盒测定。
1.3 统计分析采用SPSS 10.0软件进行统计分析,组间差异比较用单因素方差分析。
2 结果 2.1 叶黄素对肺组织W/D的影响ALI模型组的肺组织W/D与对照组相比明显增加(P < 0.01);而与ALI模型组叶黄素各剂量组和地塞米松阳性组肺组织W/D明显降低(P < 0.01),其中叶黄素不同处理组显示出一定的剂量-反应关系,但叶黄素组疗效不如地塞米松阳性组(P < 0.01)。
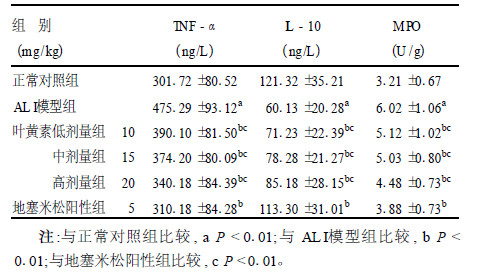
2.2 肺组织TNF-α、IL-10及MPO (表 1)| 表 1 肺组织TNF-α、IL-10及MPO含量(x±s, n=10) |
与正常对照组比较,ALI模型组小鼠肺组织TNF-α、MPO含量显著升高(P < 0.01),而IL-10含量显著降低(P < 0.01)。与ALI模型组比较,叶黄素各剂量组和地塞米松阳性组IL-10含量明显升高,TNF-α、MPO含量明显降低(P < 0.01),其中叶黄素不同处理组显示出一定的剂量-反应关系,但叶黄素组疗效不如地塞米松阳性组(P < 0.01)。
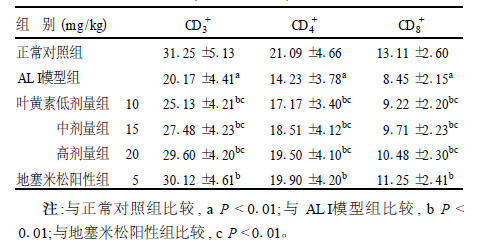
2.3 动脉血T淋巴细胞亚群CD3+,CD4+和CD8+(表 2)| 表 2 动脉血T淋巴细胞亚群CD3+,CD4+和CD8+阳性率(x±s, n=10) |
与正常对照组比较,ALI模型组小鼠动脉血中T淋巴细胞亚群CD3+,CD4+和CD8+含量显著降低(P < 0.01)。与ALI模型组比较,叶黄素各剂量组和地塞米松阳性组T淋巴细胞亚群CD3+,CD4+和CD8+明显升高(P < 0.01),其中叶黄素不同处理组显示出一定的剂量-反应关系,但叶黄素组疗效不如地塞米松阳性组(P < 0.01)。
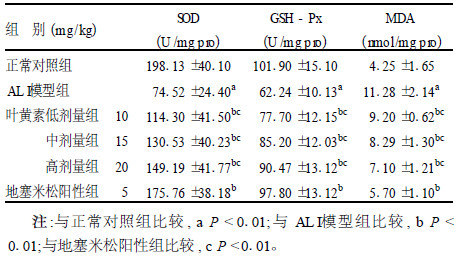
2.4 动脉血抗氧化指标(表 3)| 表 3 血清SOD、GSH-Px活性和MDA含量(x±s, n=10) |
与正常对照组比较,ALI模型组小鼠血中SOD、GSH-Px活性显著降低(P < 0.01),而MDA含量显著增加(P < 0.01)。与ALI模型组比较,叶黄素各剂量组和地塞米松阳性组血中SOD、GSH-Px活性明显升高,MDA含量明显降低(P < 0.01),其中叶黄素不同处理组显示出一定的剂量-反应关系,但叶黄素组疗效不如地塞米松阳性组(P < 0.01)。
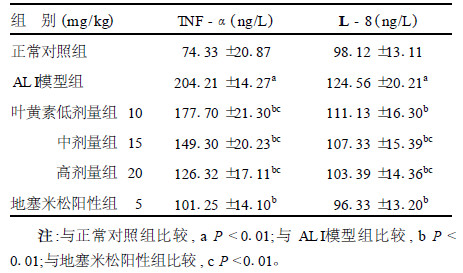
2.5 TNF-α和IL-8的检测(表 4)| 表 4 肺BALF中TNF-α、IL-8含量(x±s,n=10) |
与正常对照组比较,ALI模型组小鼠肺组织BALF中TNF-α、IL-8含量显著升高(P < 0.01)。与ALI模型组比较,叶黄素各剂量组和地塞米松阳性组TNF-α、IL-8含量明显降低(P < 0.01),其中叶黄素不同处理组显示出一定的剂量-反应关系,但叶黄素组疗效不如地塞米松阳性组(P < 0.01)。
3 讨论诱发ALI的因素众多,免疫细胞过度活化和免疫炎性因子大量释放,导致病理损伤,引起系统性炎性反应综合征(SIRS),最终导致机体的病理损害甚至死亡〔4, 5〕。研究表明,当机体摄入脂多糖(LPS),体内肺组织细胞中的自由基代谢平衡就会失调,对自由基的防御能力也会下降,不饱和脂肪酸过氧化而形成脂质过氧化产物及其代谢产物MDA,最后导致细胞无法维持正常代谢而死亡〔6, 7〕。本实验结果表明,与ALI模型组比较,叶黄素各剂量组均升高血SOD、GSH-Px活性,降低MDA含量,说明叶黄素可以改善LPS所致ALI模型小鼠抗氧化能力。
研究表明,T淋巴细胞亚群的测定有助于了解机体免疫状况及一些疾病的监测。辅助性T细胞功能低下,机体易发生感染,抑制性T细胞功能低下可能发生过强免疫反应〔8, 9〕。本研究结果显示,ALI组小鼠CD3+,CD4+、CD8+有降低趋势,而叶黄素不同剂量组均高于ALI组。
TNF-α是ALI炎症反应中重要的启动因子,也是介导早期ALI的主要细胞因子。它可以直接损伤肺血管内皮细胞,介导炎症反应损伤肺组织〔10〕。L-8是嗜中性粒细胞(PMN)最有效和最主要的趋化因子,ALI时L-8升高较晚但持续时间长,因此,L-8在ALI发病后期损伤及预后转归上起着更为重要的作用〔11〕。而L-10为抗炎因子,主要是由单核/巨噬细胞、T细胞、B细胞产生,影响前炎症细胞因子的产生〔12〕。本实验结果表明,叶黄素呈剂量依赖性地抑制TNF-α、IL-8的分泌,而提高L-10。
综上所述,叶黄素能降低由于LPS诱发的肺组织W/D、TNF-α、IL-8、MPO活性升高,增强IL-10分泌与抗氧化能力,改善T淋巴细胞亚群CD3+,CD4+、CD8+分布,但作用不弱于地塞米松,表明叶黄素可能通过调节促炎性因子、抗炎因子的释放以及拮抗氧应激产生保护作用,其确切机制有待进一步研究。
| [1] | 凌亦凌, 黄新莉. 呼吸衰竭发病机制的研究进展[J]. 临床内科杂志, 2004, 21 : 649–652. |
| [2] | 惠伯棣. 类胡萝卜素化学与生物化学[M]. 北京: 中国轻工业出版社, 2005: 156-168. |
| [3] | 蒋灿华, 叶冬霞, 陈万涛, 等. 中药参阳方冲剂对舌鳞癌SD大鼠外周血淋巴细胞亚群的调节作用[J]. 中华口腔医学杂志, 2005, 40(5) : 118–121. |
| [4] | 徐淑云, 卞如濂, 陈修. 药理学实验方法学[M].3版. 北京: 人民卫生出版社, 2002: 34-61. |
| [5] | 张殿军, 林晓明. 番茄红素对急性肺损伤大鼠肺泡巨噬细胞影响[J]. 中国公共卫生, 2007, 23(1) : 34–37. |
| [6] | Chan T Y. Oxidative DNA damage, antioxidants and cancer[J]. J Pineal Rea, 1996, 20(6) : 187–191. |
| [7] | 陈华远, 徐德祥, 赵磊, 等. 抗坏血酸对细菌脂多糖引起发育毒性保护作用[J]. 中国公共卫生, 2007, 23(2) : 110–112. |
| [8] | 孙秀泓, 罗自强. 肺的非呼吸功能基础与临床[M]. 北京: 人民卫生出版社, 2003: 320-371. |
| [9] | 孙献策, 刘珊, 陆春伟, 等. 亚砷酸钠对淋巴细胞毒性及抗氧化物拮抗作用[J]. 中国公共卫生, 2004, 20(1) : 56–58. |
| [10] | Yu Z, Ohtaki Y, Kai K, et al. Critical roles of platelets in lipopolysaccharide-induced lethality:effects of glycyrrhizin and possible strategy for acute respiratory distress syndrome[J]. Int Immunopharmacol, 2005, 17(5) : 571–580. |
| [11] | Matsui S, Matsumoto H, Sonoda Y, et al. Glycyrrhizin and related compounds down-regulate production of inflammatory chemokines IL-8 and eotaxin-1 in a human lung fibroblast cell line[J]. Int Immunopharmacol, 2004, 15(4) : 1633–1644. |
| [12] | Zhao XQ, Zhang JF, Kuang XC, et al. The effect of α-diammonium glycyrrhizinate on the expression of IL-10 and IL-18 of pulmonary alveolar marcophage from acute lung injury rats[J]. Chin J Tuberc Respir Dis, 2004, 27(3) : 126–127. |
 2009, Vol. 25
2009, Vol. 25