2. 中国科学院研究生院
多环芳烃(PAHs)是一类具有三致作用并在全球广泛分布的有机污染物,对人体健康具有潜在危害〔1〕。PAHs可通过呼吸道、皮肤接触、消化道等多种暴露途径进入人体,经体内代谢成羟基多环芳烃(OH-PAHs),并以葡萄糖醛酸、硫磺酸结合物的形式主要通过尿液排泄〔2〕。目前,国际上广泛利用尿液中OH-PAHs作为生物标志物,对PAHs在人体内的暴露水平进行综合评价〔3〕。高效液相色谱(HPLC)因具有快速、灵敏、易推广等特点,被普遍用于尿液中OH-PAHs的分析。迄今,使用HPLC同时检测尿液OH-PAHs一般在2~8种〔4, 5〕。本文在王宇等〔6〕同时检测5种OH-PAHs的基础上,对方法进行改进与完善,实现了10种OH-PAHs的同时检测。
1 材料与方法 1.1 仪器与试剂HP1100高效液相色谱仪、荧光检测器(美国Agilent公司); 十二孔固相萃取装置(美国Supeclo公司); 固相萃取visiprepTM小柱(C-18 ENVI,美国Supeclo公司); 氮吹仪(美国Pierce公司); Phenomenex Prodisy ODS (2)反相柱(250 mm×4.6 mm,5.0 μm),C-18预柱(ODS octadecyl, phenomenex), 0.2 μm聚四氟乙烯膜滤头(上海安谱科学仪器有限公司)。1-羟基萘、2-羟基萘、2-羟基芴、9-羟基菲、1-羟基芘(美国Sigma公司); 2-羟基菲、3-羟基菲和4-羟基菲(德国Dr Ehrenstorfer公司); 3-羟基苯并(a)芘(美国the NCI Chemical Carcinogen Repositories公司); 6-羟基䓛(美国Accustaudard公司); 色谱纯甲醇等有机溶剂(德国Merck公司); 水为二次蒸馏水; β-葡萄糖苷酸-芳基硫酸酯酶(每毫升中含122 400单位β-葡糖苷酸酯酶和3 610单位芳基硫酸酯酶,美国Sigma公司)。
1.2 标准溶液分别用甲醇配制10种OH-PAHs标准品的储备液,再以甲醇为溶剂配制一系列浓度不同的混合标准样品。每种目标化合物各取8个点,其浓度范围(μg/L)分别为:1-羟基萘(1.96~125.25)、2-羟基萘(2.39~153)、2-羟基芴(6.34~405.6)、2-,3-,4-羟基菲(2.34~150),9-羟基菲(2.52~161.25)、1-羟基芘(2.23~143)、6-羟基䓛(1.82~116.25)和3-羟基苯并(a)芘(1.23~78.25)。
1.3 尿样收集采集广东省某中学学生晨尿,主要用于分析方法的验证。
1.4 实验方法 1.4.1 样品预处理按文献〔3〕进行尿样预处理。
1.4.2 色谱条件采用甲醇-水梯度洗脱。进样量为20 μl; 流速0.6 ml/min; 柱温40 ℃。流动相切换程序:0~5 min,甲醇60%;5~14 min,甲醇60%~78%;14~21 min,甲醇78%~85%;21~30 min,甲醇85%~100%;30~35 min,甲醇100%;35~39 min,甲醇60%~100%;3 945 min,甲醇60%。荧光(激发波长/发射波长,Ex/Em)切换的时间程序:0 min,Ex/Em=227 nm/355 nm; 16 min, Ex/Em=272 nm/336 nm; 19.5 min, Ex/Em=254 nm/369 nm; 23 min, Ex/Em=239 nm/392 nm; 26 min, Ex/Em=269 nm/392 nm; 28 min, Ex/Em=263 nm/439 nm。
2 结果 2.1 各OH-PAHs荧光条件的优化对于同一多环芳烃化合物,其不同羟基取代异构体,在最佳荧光检测条件下仍有一定差别。10种OH-PAHs进行荧光条件优化的结果分别为(Ex/Em,nm):1-羟基萘(230/358)、2-羟基萘(227/355)、2-羟基芴(272/336)、2-羟基菲(254/369)、3-羟基菲(250/358)、9-羟基菲(284/383)、4-羟基菲246/371)、1-羟基芘(239/392)、6-羟基䓛(269/392)和3-羟基苯并(a)芘(263/439)。
2.2 HPLC流动相条件的优化分别选择甲醇-水、乙腈-水以及甲醇-乙腈-水等流动相体系,通过梯度洗脱调整流动相溶剂之间的极性、流速,并分别采用Phenomenex Prodisy ODS (2)、Zorbax Eclipse plus C18, Discovery RP-amide C16等不同填充材料的反相色谱柱进行对比,确定液相色谱分析条件。10种OH-PAHs的出峰时间分别为:2-羟基萘13.5 min; 1-羟基萘14.6 min; 2-羟基芴18.8 min; 2+3-羟基菲20 min; 9-羟基菲20.9 min; 4-羟基菲21.4 min; 1-羟基芘24.4 min; 6-羟基䓛27.1 min; 3-羟基苯并(a)芘(31.1min); 其中2-羟基菲和3-羟基菲仍无法得到完全基线分离(图 1)。
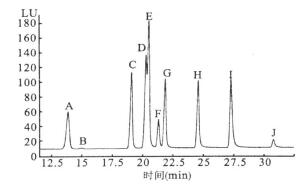
|
图 1 10种OH-PAHs混合标样的色谱图 |
从目前文献报道看,只有GC-MS可将不同羟基取代位的菲进行完全基线分离,但该方法需要采用衍生化〔7〕,且对样品的净化处理要求较高,因此,国际上通常采用HPLC进行分析。利用HPLC进行分析,大多数文献报道中2-,3-羟基菲属共溢出峰〔8〕,而在本文中这2个化合物的分离已得到一定程度改善。综合各方面因素,本试验最终选择使用Phenomenex Prodisy ODS (2)分析柱。
2.3 分析方法的质量控制 2.3.1 标准曲线和检测限标样由低浓度到高浓度依次连续进样3次,取其峰面积的平均值,以峰面积为横坐标,以目标化合物的质量(ng)为纵坐标绘制标准曲线。10种OH-PAHs的标准方程分别为:1-羟基萘Y=7.259X+3.463;2-羟基萘Y=0.172X+0.393;2-羟基芴Y=0.29X+0.129;2-羟基菲Y=0.101X+0.202;3-羟基菲Y=0.067X-0.028;4-羟基菲Y=0.128X+0.138;9-羟基菲Y=0.36X+0.204;1-羟基芘Y=0.103X+0.667;6-羟基䓛 Y=0.08X-0.453;3-羟基苯并(a)芘Y=0.242X+0.002。其R2均在0.999以上。10种OH-PAHs在给定的浓度范围内呈良好的线性关系。
将标样稀释且多次进样,直至信噪比(S/N)到3左右,得出10种OH-PAHs的仪器检出限(LOD)。除3-羟基苯并(a)芘为1.35 μg/L外,其余OH-PAHs的检测限在0.23~0.93 μg/L。
2.3.2 回收率采用基质加标测定各目标化合物的回收率。取3组尿样,每组6个平行样品。除一组为空白尿样外,其余2组分别加入高浓度混合标样(31~108.2 ng)和低浓度混合标样(7~24.3 ng)。尿样的前处理过程和仪器分析条件均为前述的优化条件。每一样品均连续进样2次,取测定结果的平均值。除3-羟基苯并(a)芘外,9种OH-PAHs的回收率为75%~98%。虽然3-羟基苯并(a)芘的回收率较低(66%),但与国外文献报道基本一致〔9〕。
2.3.3 精密度取2组尿样,每组6个平行样品,分别加入高浓度标样和低浓度标样。在同一天内用相同的前处理过程和仪器分析条件测定,每个连续6次进样,计算日内精密度。在以后的30 d内选取6 d对上述样品进行仪器分析,确定日间精密度。其中日内相对标准偏差(RSD)范围为1.5%~6.2%;日间RSD范围为1.3%~10.2%。各个目标化合物的日内、日间精密度均良好。
2.4 实际样品的分析应用上述方法对21名中学男生尿样进行测定。共检测出2-羟基萘、2-羟基芴、2-羟基菲、3-羟基菲、4-羟基菲、9-羟基菲、1-羟基芘7种OH-PAHs。其中4-羟基菲检出率为41%,其他6种化合物检出率为100%。7种目标化合物的含量范围、中值及平均值分别为(μmol/mol肌酐):2-羟基萘0.58~14.95,3.62,4.27;2-羟基芴0.68~6.17;1.55,1.74;2+3羟基菲0.09~0.69,0.23,0.25;4-羟基菲0~0.13,0,0.02;9-羟基菲0.19~4.94,0.45,0.72;1-羟基芘0.06~0.58;0.18,0.22。
3 小结本研究建立了检测10种OH-PAHs的高效液相色谱-荧光检测分析方法,可同时测定尿样中1-,2-羟基萘、2-羟基芴、2-,3-,4-,9-羟基菲、1-羟基芘、6-羟基䓛和3-羟基苯并(a)芘等10种OH-PAHs。该方法具有较高的灵敏度、精密度和较好的重复性、回收率,可用于PAHs在人体内暴露的生物监测。
| [1] | 袭著荣, 晁福寰, 孙咏梅, 等. 室内发源性多环芳烃对DNA的氧化损伤[J]. 中国公共卫生, 2004, 20(9) : 1034–1036. |
| [2] | 牛红云, 蔡亚岐, 魏复盛, 等. 多环芳烃暴露的生物标志物-尿中羟基多环芳烃[J]. 化学进展, 2006, 18(10) : 1381–1390. |
| [3] | Elovaara E, Mikkola J, Mäkelä M, et al. Assessment of soil remediation worker's exposure to polycyclic aromatic hydrocarbons (PAH):Biomonitoring of naphthols, phenanthrols, and 1-hydroxpyrene in urine[J]. Toxicology Letters, 2006, 162 : 158–163. DOI:10.1016/j.toxlet.2005.09.028 |
| [4] | Elovaara E, Mikkola J. Simultaneous analysis of naphthols, phenanthrols, and 1-hydroxypyrene in urine as biomarkers of polycyclic aromatic hydrocarbon exposure:intra individual variance in the urinayr metabolite excretion profiles caused by intervention with b-naph-thoflavone induction in the rat[J]. Arch Toxicol, 2003, 77 : 183–193. DOI:10.1007/s00204-003-0436-0 |
| [5] | 段小丽, 杨洪彪, 张林, 等. 尿液中多环芳烃基代谢产物分析方法研究[J]. 环境科学研究, 2004, 17(3) : 62–65. |
| [6] | 王宇, 董玉莲, 范瑞芳, 等. 尿中多种多环芳烃代谢同时测定的高效液相谱-荧光检测法[J]. 环境与健康杂志, 2006, 23(1) : 76–78. |
| [7] | Gmeiner G, Krassning C, Schimid E, et al. Fast screeing method for the profile analysis of polycyclic aromatic hydrocarbon metabolites in urine using derivatisation-solid-phase microextraction[J]. J Chormatogr B Biomed Sci Appl, 1998, 705 : 132–138. DOI:10.1016/S0378-4347(97)00526-4 |
| [8] | Kuusimäki L, Peltonen Y, Mutanen P, et al. Urinary-metabolites of naphthalene, phenanthrene and pyrene as biomarkers of exposure to diesel exhaust[J]. Int Arch Occup Environ Health, 2004, 77 : 23–30. DOI:10.1007/s00420-003-0477-y |
| [9] | Hollender J, Koch B, Dott W. Biomonitoring of envirmental polycyclic hydrocarbon exposure by simultaneous of measurement of urinary phenanthrene, pyrene and benzo[a]pyrene hydroxides[J]. J Chromatogr B, 2000, 739 : 225–229. DOI:10.1016/S0378-4347(99)00470-3 |
 2009, Vol. 25
2009, Vol. 25

 , 盛国英1, 傅家谟1
, 盛国英1, 傅家谟1