2. 温州医学院药学院
日光中的紫外线,尤其是中波紫外线(UVB,波长280~320 nm)是危害人类健康的重要环境因素。UVB是引起光敏性皮肤病、光老化和皮肤癌的主要病因〔1〕。天然植物药物主要基于其含有许多能够抑制及捕获多种自由基生物活性成分,这些成分具有活化细胞、保持细胞膜结构与功能正常的作用。有研究证实〔2〕,多羟基酚类化合物,如绿茶多酚、姜黄素(Cur)等具有清除活性氧自由基(ROS)和抗脂质过氧化的作用,直接防止胶原蛋白等生物大分子免受ROS的损伤作用。因此,各种天然抗氧化剂的研究受到人们越来越多的重视。HaCaT细胞株是一种自发转化的人类皮肤良性角质形成细胞,与正常皮肤有许多相类似的特性,常被用于体外药理实验〔3〕。姜黄素是从姜科植物莪术的根茎中提取的主要有效成分。近年来研究发现,Cur具有抗氧化、抗炎及免疫调节、抗肿瘤等作用〔4〕。本研究观察Cur对UVB辐射HaCaT细胞线粒体及其相关因子的影响,通过罗丹明123和Fluo-3/AM荧光强度检测细胞线粒体膜电位(Δψ)和细胞内游离钙离子浓度([Ca2+]i),以流式细胞术检测caspase-3和细胞色素c (Cytc)凋亡相关蛋白的表达,探讨其对UVB损伤细胞的保护作用及其机制。结果报告如下。
1 材料与方法 1.1 材料人类角质形成细胞HaCaT细胞(第二军医大学长海医院顾军教授惠赠); 姜黄素(沈阳中药制品研究所); 基础培养基(MEM)、10%新生小牛血清(美国Sigma公司); FACScan流式细胞仪(美国Becton Dickinson公司)。
1.2 方法 1.2.1 细胞培养HaCaT细胞用基础培养基(MEM)置于37 ℃、5% CO2的饱和水汽CO2培养箱培养,待细胞80%~90%融合时,倾去瓶中培养基,用含0.10%~0.25%胰酶消化液消化细胞。1 000 r/min离心3 min,去上清,加入培养基吹打成细胞悬液,接种培养板。取指数生长期的细胞进行实验。
1.2.2 实验分组及UVB辐射实验分为对照组、UVB辐射模型组和UVB+1.25,2.5,5.0 μg/ml姜黄素组。将细胞用D-Hanks液冲洗3次,然后加入D-Hanks液覆盖,细胞暴露于UVB下,辐射剂量为30 mJ/cm2。辐射后吸去D-Hanks液,UVB辐射组加入新鲜培养液,UVB + Cur组分别加入不同浓度的Cur,每组设3个平行样。对照组不加药物,其余处理同UVB + Cur组。然后继续培养18 h。
1.2.3 游离钙离子浓度([Ca2+]i)测定细胞经UVB辐射并继续培养18 h后,从培养板上消化下来,用预冷的磷酸盐缓冲液(PBS)洗2次,取细胞悬液100 μl,加入5 μmol/L的Fluo-AM 100 μl,37 ℃水浴30 min,离心去上清,用PBS洗去未结合的染色剂,流式细胞仪测定Fluo-AM的荧光强度,即为[Ca2+]i浓度。
1.2.4 细胞线粒体膜电位(Δψ)检测细胞经UVB辐射并继续培养18 h后,消化贴壁细胞,用预冷PBS洗2次,并重悬于培养基中。加入罗丹明123(Rhodamine,Rh123),培养箱培养10 min,离心去上清后,培养箱培养60 min,流式细胞仪测定其荧光强度,检测细胞线粒体膜电位变化。
1.2.5 半胱氨酸天冬氨酸酶(caspase-3)和细胞色素c (Cyt c)凋亡相关蛋白表达检测将接种于6孔板的细胞经UVB辐射并继续培养18 h后,消化细胞,离心去上清,用70%的冰乙醇固定24 h以上; 然后,分别加入一抗、封闭血清和二抗,非特异组加PBS; 混匀后,流式细胞仪收集10 000个细胞,检测凋亡蛋白表达。凋亡蛋白百分率(%)以特异和非特异的差表示。
1.3 统计分析采用SPSS 12.0软件进行单因素方差分析(one-way ANOVA)。
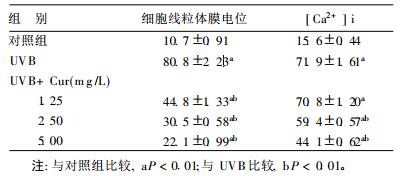
2 结果 2.1 [Ca2+]i及细胞线粒体膜电位变化(表 1)| 表 1 Cur对UVB辐射HaCaT细胞的影响(n=3, x±s, %) |
表 1可见,与对照组比较,UVB辐射模型组细胞[Ca2+]i和具有低线粒体膜电位的细胞数均明显升高(P < 0.01);辐射后加入Cur,UVB+Cur各组与UVB辐射模型组比较,其中[Ca2+]i的UVB + 2.5 μg/ml Cur和UVB + 5.0 μg/ml Cur组以及细胞线粒体膜电位各UVB + Cur组的差异均有统计学意义(P < 0.01),并呈Cur剂量-效应关系,即随Cur剂量增加,[Ca2+]i显著降低,具有低线粒体膜电位的细胞数显著减少。
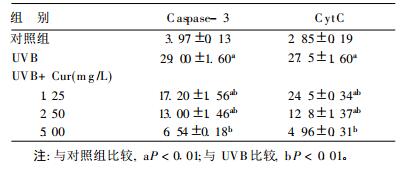
2.2 caspase-3和Cyt c凋亡相关蛋白表达(表 2)| 表 2 Caspase-3和Cytc凋亡相关蛋白表达的影响(n=3, x±s, %) |
与对照组比较,UVB辐射模型组caspase-3与Cytc蛋白表达均明显升高(P < 0.01),除UVB+5.0 μg/ml Cur组外,其余UVB+Cur组其含量明显高于对照组(P < 0.01),但均明显低于UVB辐射模型组(P < 0.01),并呈现Cur剂量-效应关系,即随Cur剂量增加,其含量下降更明显。
3 讨论大气臭氧层的破坏导致了到达地面的紫外线明显增加, 长期过量的紫外线照射(UVR)可引发多种疾病, 尤其表现在皮肤UV损伤和皮肤癌的发病率不断增加, 某些抗氧化剂可有效减少UVR所诱发的碱基突变和癌变的发生。因此, 寻求高效的活性氧自由基拮抗剂(抗氧化剂)是预防和治疗UVR损伤的重要手段之一〔5〕。Denning MF等〔6〕在研究蛋白激酶C与UVB诱导HaCaT细胞凋亡时观察到,UVB辐射HaCaT细胞后24 h,低细胞线粒体膜电位细胞占52%。本研究结果显示,30 mJ/cm2的UVB导致(80.8±2.23)%的HaCaT细胞具有低细胞线粒体膜电位; 经流式细胞仪检测,与对照组比较,caspase-3和Cyt C蛋白表达量均有明显提高。提示细胞线粒体膜电位电位下降至少是UVB诱导HaCaT细胞凋亡的机制之一。研究显示,各种细胞系在受到各种不同刺激而发生凋亡时,[Ca2+]i浓度升高是凋亡发生的早期事件〔7〕。本研究结果也显示,HaCaT细胞经UVB辐射后,[Ca2+]i浓度明显升高。
Cur是一广谱的抗氧化剂,能够清除包括单线态氧、超氧阴离子以及过氧化氢等在内的多种活性氧自由基〔8, 9〕。本研究结果显示,经紫外线辐射后立即加入Cur,则明显拮抗UVB引起细胞线粒体膜电位电位下降和[Ca2+]i浓度增加,使经UVB辐射HaCaT细胞表达明显增加的caspase-3和Cyt C蛋白表达下降,提示UVB可降低细胞线粒体膜电位电位和增加[Ca2+]i浓度,表明Cur对氧化应激的保护作用可能与其抑制细胞细胞线粒体膜电位降低有关,并抑制凋亡信号caspase-3的作用。
本研究结果提示,Cur可能通过提高细胞线粒体膜电位,降低[Ca2+]i含量,减弱CytC和caspase-3的级联反应,达到其抑制UVB辐射引起的HaCaT细胞凋亡,具有对UVB损伤HaCaT细胞的保护作用。
| [1] | 蔡宝祥, 骆丹, 林向飞. 人参皂苷Rb1对UVB诱导原代角质形成细胞光损伤的影响[J]. 中国美容医学, 2008, 17(9) : 1315–1317. |
| [2] | 刘国安, 杨燕, 丁兰, 等. 几种天然抗氧化剂对DNA氧化损伤的保护作用[J]. 四川大学学报, 2006, 3(1) : 238–241. |
| [3] | 郭志丽, 顾军, 米庆军, 等. 来氟米特对角质形成细胞增殖及凋亡的影响[J]. 中华皮肤科杂志, 2005, 36(10) : 580–582. |
| [4] | 姚崇舜. 天然药物温莪术[M]. 北京: 人民卫生出版社, 2008: 1-326. |
| [5] | 李晶, 刘扬, 孙炜, 等. 抗氧化剂对紫外线诱发DNA损伤的保护作用[J]. 中国公共卫生, 2004, 20(2) : 177–179. |
| [6] | Denning MF, Wang Y, Tibudan S, et al. Caspase activation and disruption of mitochondrial membrane potential during UV radiation-induced apoptosis of human keratinocytes requires activation of protein kinase C[J]. Cell Death Differ, 2002, 9(1) : 40–44. DOI:10.1038/sj.cdd.4400929 |
| [7] | Tombal B, Denmeade SR, Gillis JM, et al. A supram icromolar elevation of intracellular free calcium ([Ca2+]i) is consistently required to induce the execution phase of apoptosis[J]. Cell death Differ, 2002, 9(5) : 56–60. |
| [8] | 卢新军, 蒋和体. 姜黄素生理功能及其在食品工业中的应用前景[J]. 中国食物与营养, 2006, 4 : 31–32. |
| [9] | Das KC. Curcum in (diferuloylm ethane), a singlet oxygen quencher[J]. Biochem Biophys Res Commun, 2002, 295(1) : 62–66. DOI:10.1016/S0006-291X(02)00633-2 |
 2009, Vol. 25
2009, Vol. 25

 , 李校堃2
, 李校堃2