2. 贵阳医学院多媒体形态学实验室
亚洲牛带绦虫(Taenia saginata asiatic)是一种介于猪带绦虫和牛带绦虫之间的人体带绦虫,其成虫特征几乎和牛带绦虫一致,但其中间宿主主要是猪,人因生食猪肝等内脏而感染〔1-3〕。近年来,本课题组在亚洲牛带绦虫和牛带绦虫的流行病学、分类学、生态学、发育生物学、组织病理学和免疫学等传统寄生虫学领域进行了研究,摸清了2种带牛绦虫在我国西部省区的分布情况和主要传播方式〔4, 5〕。2006年,在前期研究的基础上开启了对亚洲牛带绦虫功能基因组学的研究〔6〕。本研究通过筛选亚洲牛带绦虫成虫cDNA质粒文库, 寻找、识别出亚洲牛带绦虫CRISP (TaCRISP)新基因, 将其编码区克隆到原核表达质粒pET-30a (+)中, 并在大肠埃希菌BL-21/DE3中表达出融合蛋白, 为进一步研究其功能提供基础依据。
1 材料与方法 1.1 材料 1.1.1 文库、质粒、菌株虫体标本采自亚洲牛带绦虫流行区贵州省都匀市米秀乡,亚洲牛带绦虫成虫全长cDNA质粒文库的构建和标签(EST)测序及Unigene分析与上海联合基因有限公司合作完成。编码亚洲牛带绦虫CRISP基因文库质粒编号为Ta HC10-A11,接收登录号为EF420485。原核表达质粒pET-30a (+)和大肠埃希菌BL-21/DE3由中山医学院病原生物学实验室保存。
1.1.2 主要试剂和工具酶Ex Taq酶(含dNTP),NedⅠ,XhoⅠ,T4 DNA连接酶,DNA标准(DL 15,000;DL 2,000)(大连宝生物工程公司); 异丙硫代-β-D半乳糖苷(IPTG)(美国Promega公司); Ni-IDA Agarose (cat No:69670)(美国Novagen公司); 蛋白分子量标准(立陶宛MBI公司); DNA凝胶回收试剂盒、质粒纯化试剂盒(北京赛百盛基因公司)。
1.1.3 引物合成和DNA测序基因扩增引物和重组质粒DNA测序由Introvigen上海生物技术有限公司合成。
1.2 方法 1.2.1 Ta CRISP基因的识别利用开放阅读框(ORF Finder)探寻器确定其完整编码序列并显示其编码的氨基酸序列。利用蛋白分析专家系统服务器ExPASy Proteomics Server (http://ca.expasy.org/)所提供的蛋白质在线分析工具,如protparam (http://au.expasy.org/tools/protparam.html)预测氨基酸序列的分子量、等电点、稳定性指数等理化性质; InterPro Scan (http://www.ebi.ac.uk/InterProScan/)和MotifScan (http://myhits.isb-sib.ch/cgi-bin/motif_scan)预测氨基酸序列中的功能域。
1.2.2 CRISP基因的扩增根据已获得的CRISP编码序列,利用DNAClub和PCRdesign去除信号肽设计引物。上游引物:AATCATATGGAAAGACCAACAGAGGCAGAACGC,带NedⅠ酶切位点; 下游引物:AGCCTCGAGCTGAACAAGTAGGTAAACGATGAG,带Xho Ⅰ酶切位点。以亚洲牛带绦虫成虫cDNA文库中CRISP基因的克隆质粒为模版,94 ℃预变性5 min后,热循环参数为94 ℃ 1 min,61 ℃ 1 min,72 ℃ 1 min,共35个循环,最后72 ℃延伸10 min。PCR产物1%琼脂糖凝胶电泳回收。
1.2.3 重组原核表达质粒的构建及鉴定将PCR产物和原核表达质粒pET-30a (+)经NedⅠ,Xho Ⅰ双酶切后回收,连接,转化大肠埃希菌BL-21/DE3感受态细胞,卡那霉素筛选阳性克隆。对阳性克隆提取质粒进行PCR,双酶切和测序鉴定。
1.2.4 CRISP基因在大肠埃希菌BL-21/DE3中的诱导表达取50 μl培养过夜的阳性克隆菌液,加入含有卡那霉素的5 ml LB培养基中(菌液/培养基为1/100),37 ℃ 250 r/min振摇至A 600为0.4~0.6时,加入异丙基硫代-β-D半乳糖苷(IPTG)至终浓度1 mmol/L,诱导表达5 h。离心收集菌体,在沉淀中加入100 μl上样缓冲液,煮沸5~10 min,13 000 r离心,1 min取上清10 μl进行十二烷基磺酸钠聚丙烯胺凝胶(SDS-PAGE)电泳分析。
1.2.5 CRISP基因在大肠埃希菌BL-21/DE3中的表达按照上述方法对阳性克隆进行大量诱导表达,离心收集菌体,按每g菌体加入4 ml结合缓冲液重悬菌体,冰上放置30 min后冰上超声裂解(功率150 W,持续1 s,停2 s,共15 min),4 ℃ 13 000 r/min离心20 min,收集上清,取30 μl加入10 μl SDS-PAGE上样缓冲液处理样品,12%SDS-PAGE,考马斯亮兰R 250染色。
2 结果 2.1 BlASTX分析结果从BLASTX分析结果看,该基因与GenBank中殖孔绦虫(登录号为AAT74668)(CRISP)同源基因的一致性为38%,相似性为54%。比对结果,该克隆基因的5′端序列长于中殖孔绦虫CRISP完整编码序列, 其最大的ORF就是其完整的编码区,该基因全长1 090 bp, 编码区为153~870,编码239个氨基酸,在5′端和3′端都有非翻译区,1aa-16aa为信号肽, 方框内是该蛋白CRISP-1和CRISP-2功能结构域的所在位置, 为421:YYLQMVWGN; 541:YLLTCAYTPPG,所以推测为亚洲牛带绦虫成虫CRISP的全长基因序列。
2.2 蛋白质的理化性质预测亚洲牛带绦虫CRISP的理论分子量和等电点分别是26 973.8和5.96。假设形成3对二硫键时,280 nm处的摩尔消光系数为47 620 mol/cm, 0.1%浓度(1 g/L)的Abs为1.765;假设二硫键全部打开时,280 nm处的摩尔消光系数为46 870 mol/cm 0.1%浓度(1 g/L)的Abs为1.738。当成熟肽N端的一个氨基酸为蛋氨酸时,在哺乳动物网状红细胞体外表达的半衰期为30 h, 在酵母和大肠埃希菌中体内表达的半衰期分别>20和10 h。在溶液中的不稳定指数为37.92, 低于域值40,在溶液中性质稳定。
2.3 亚细胞定位通过蛋白分析专家系统服务器ExPASy Proteomics Server (http://ca.expasy.org/)所提供的蛋白质在线分析该基因具分泌型信号肽,1aa-16aa为信号肽位置。
2.4 InterPro Scan扫描一级结构中包含的结构和功能域特征序列该氨基酸序列中含有4个V5TPLIKE催化位点motif, 并含有CRISP和SCP的功能域,推测其可能具有半胱氨酸分泌蛋白功能。
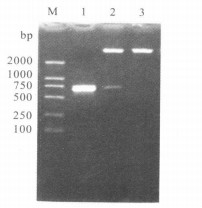
2.5 原核重组质粒的鉴定(图 1)
|
注:M:DNA标准(DL2000);1:CR ISP的PCR产物; 2:pET-30a (+)-Ta CR ISP的双酶切; 3:pET-30a (+)-Ta CRISP重组质粒。 图 1 组质粒的PCR及双酶切鉴定图 |
将重组质粒进行PCR和双酶切鉴定,产物进行1%琼脂糖凝胶电泳。第1泳道是PCR产物,第2泳道是双酶切鉴定结果,在750~500 bp之间有一清晰的条带,与目的基因(719 bp)的大小基本相符,证明重组质粒构建成功。注:M:DNA标准(DL2000);1:CRISP的PCR产物; 2:pET-30a (+)-Ta CRISP的双酶切; 3:pET-30a (+)-Ta CRISP重组质粒。
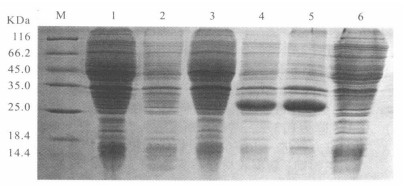
2.6 蛋白表达结果(图 2)
|
注:M:蛋白标准; 1:pET-30a (+)质粒未加IPTG诱导; 2:pET-30a (+)质粒加IPTG诱导; 3:pET-30 a (+)-Ta CR ISP重组质粒未加IPTG诱导; 4:pET-30a (+)-Ta CR ISP重组质粒加IPTG诱导; 5: pET-30 a (+)-Ta CR ISP重组质粒沉淀; 6:pET-30 a (+)-Ta NO-MO1重组质粒上清。 图 2 重组质粒pET-30a (+)-CR ISP在大肠埃希菌BL-21/DE3的SDS-PAGE电泳分析 |
将构建好的重组质粒转化到E.coli BL-21/DE3中表达,SDS-PAGE电泳分析结果第4,5泳道所示,大约在30 kD左右处出现表达条带,与目的蛋白分子量基本相符。
3 讨论寄生虫的半胱氨酸蛋白酶(CRISP)是目前的研究热点,对它的研究不仅揭开了寄生虫与宿主相互作用机制,也为寄生虫的诊断和防治提供了新的思路〔7, 8〕。本研究通过BLASTX从亚洲牛带绦虫cDNA文库中识别出了一个编码CRISP的全长基因,并通过生物信息学的方法对其所编码蛋白的结构和功能进行预测,该蛋白为分泌型蛋白,具分泌信号肽,并具有半胱氨酸蛋白所特有的SCP、CRISP-1和CRISP-2结构功能域,该基因与GenBank中殖孔绦虫(登录号为AAT74668) CRISP同源基因的一致性为38%,相似性为54%,所以推测为半胱氨酸蛋白酶(CRISP)〔9, 10〕。
本研究将亚洲牛带绦虫成虫CRISP克隆到原核表达质粒pET-30a (+)中,双酶切及DNA测序结果均表明,pET-30a (+)-Ta CRISP重组质粒构建成功。在大肠埃希菌BL-21/DE3中用IPTG诱导表达,表达产物通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行鉴定。SDS-PAGE结果表明,该蛋白在全菌和沉淀中都有表达,但在上清中未见表达,说明CRISP是包涵体蛋白,在今后的实验中可以通过破包涵体得到纯化蛋白。本研究为进一步研究亚洲牛带绦虫CRISP的生物功能及其该蛋白在诊断、药物及疫苗研究中的应用前景提供了线索。
| [1] | Fan PC. Experimental infection of Indonesia Taenia(Somosir strain) domestic animals[J]. International Journal of Parasitology, 1989, 19(7) : 809–812. DOI:10.1016/0020-7519(89)90070-2 |
| [2] | Fan PC. Experimental infection of Philippine Taenia in domestic Animals[J]. International Journal of Parasitology, 1992, 22(2) : 235–238. DOI:10.1016/0020-7519(92)90107-V |
| [3] | Fan PC, Chung WC. Taenia saginata asiatica: epidemiology, infection, immunological and molecular studies[J]. Microbiology Immunology and Infection, 1998, 31 : 84–89. |
| [4] | 包怀恩. 我国亚洲牛带绦虫研究的现状和展望[J]. 热带医学杂志, 2002, 2(3) : 215–219. |
| [5] | 莫兴泽, 包怀恩, 戎聚全, 等. 亚洲牛带绦虫与从江牛带绦虫实验感染牛和猪的比较研究[J]. 中国寄生虫病防治杂志, 2005, 18(2) : 120–123. |
| [6] | 黄江, 胡旭初, 包怀恩, 等. 亚洲牛带绦虫成虫全长cDNA质粒文库的构建及EST测序[J]. 热带医学杂志, 2007, 7(2) : 116–118. |
| [7] | 黄江, 胡旭初, 徐劲, 等. 亚洲牛带绦虫26kDa GST基因表达及免疫学分析[J]. 中国公共卫生, 2008, 24(8) : 970–972. |
| [8] | Wang Y. Interaction of cysteine proteinase in parasite and host[J]. International Journal of Medical Parasitic Diseases, 2001, 28(4) : 145–149. |
| [9] | Britos L, Lalanne AL, Castillo E, et al. Mesocestoides corti (syn.vogae, cestoda):characterization of genes encoding cysteine-rich secreted proteins (CRISP)[J]. Experimental Parasitology, 2007, 116(2) : 95–102. DOI:10.1016/j.exppara.2006.11.008 |
| [10] | Schroeder F, Atshaves BP, Mclntosh AL, et al. Sterol carrier protein-2:new roles in regulating lipid rafts and signaling[J]. Biochimica et Biophysica Acta, 2007, 1771 : 700–718. DOI:10.1016/j.bbalip.2007.04.005 |
| [11] | Buchfelder M, Fahlbusch R, Merz T, et al. Clinical correlates in acromegalic patients with pituitary tumors expressing GSP oncogenes[J]. Pituitary, 1999, 1 : 181–185. DOI:10.1023/A:1009905131334 |
 2009, Vol. 25
2009, Vol. 25

 , 廖兴江2, 郎书源2, 周灵贵2, 申萍香2
, 廖兴江2, 郎书源2, 周灵贵2, 申萍香2