2. 同济大学医学院生物教研室
镍是普遍存在于地壳中的一种金属。含镍产品的广泛应用使得镍不可避免地导致环境的污染。人类在工作和生活中与之广泛接触,使得大量镍和镍的化合物通过职业环境接触和饮食沉积于体内,并对人类健康产生不利影响〔1〕。人群流行病学调查和动物实验均已证实,镍的职业性接触可以引起癌症,主要是肺癌〔2〕。目前有关镍的毒性和致癌机制的研究较多,但有关镍化合物对大鼠肺泡巨噬细胞(AM)凋亡及机制的研究较少。本文研究镍化合物的毒性作用和致癌机制,为制定相关措施提供科学依据。
1 材料与方法 1.1 实验动物健康雄性SD大鼠,体重(180±30)g (复旦大学医学院实验动物中心)。
1.2 试剂和仪器bis Benzimide H 33342 Trihydrochloride、PⅠ和Rhodamine 123 (美国Sigma公司);钙离子荧光染料Fluo-3AM (美国Calbiochem公司);RNA酶(上海国药集团化学试剂有限公司)。ACSCalibur流式细胞仪(美国BD公司);荧光显微镜(日本Nikon公司)。
1.3 实验动物分组将动物随机分为3组,每组10只。分为正常对照组、Ni3 S3处理组和Ni2O3处理组。参照文献〔3〕,分别在实验开始时、3和12个月时,在大鼠左后腿三角肌分别注射0.2 ml氯霉素(1.25 mg/ml)、含10 mg Ni3 S2或10 mg Ni2O3氯霉素悬液0.2 ml (Ni3 S2和Ni2O3配制前经高温消毒)。16个月后,取各组未死动物进行处理。
1.4 大鼠肺泡巨噬细胞收集大鼠腹主动脉放血处死,用生理盐水进行支气管肺泡灌注,离心收集灌注液中的AM制备成浓度1.5 × 106个/ml的细胞悬液,分装于培养瓶中,在含5% CO2、37℃培养箱中常规培养,待细胞贴壁后,倾去原培养液换无血清1640培养液,继续培养24 h,收集培养细胞,用于细胞(AM)凋亡、细胞周期分布、细胞内钙离子和线粒体膜电位的检测。
1.5 荧光显微镜检测凋亡细胞收集培养24 h的各组AM,磷酸盐缓冲液(PBS)洗1次,离心去上清,4℃多聚甲醛固定细胞20 min,PBS洗涤1次,加入Hoechst 33342 (终浓度10 μg/ml),37℃染色5~40 min,离心除去染液,滴片,荧光显微镜下观察并照相。
1.6 流式细胞仪测定细胞周期、凋亡细胞百分率取培养24 h的各组细胞1 × 105个,经PBS离心冲洗2次,以70%乙醇固定过夜,以PBS离心冲洗去乙醇,加入RNA酶(RNAase,终浓度为60 μg/ml),混匀,37℃温育30 min,加入碘化丙啶(PⅠ) (终浓度为50 μg/ml),4℃暗染30 min,用流式细胞仪测定PⅠ荧光强度,以sub-G1峰的细胞百分率为凋亡百分率。
1.7 流式细胞仪测定细胞内游离钙收集培养24 h的各组肺泡巨噬细胞约1 × 105个,离心去上清,用PBS洗2次,重悬细胞,加入Fluo-3 AM (终浓度为5 μmol/L),37℃温育40 min,预冷的PBS洗涤3次,根据Fluo-3 AM与胞内游离钙结合发出特殊荧光,用流式细胞仪测定细胞荧光强度λex=480 nm,λem=530 nm),以荧光强度表示细胞内游离钙含量。
1.8 流式细胞仪测定线粒体膜电位收集培养24 h的各组肺泡巨噬细胞约1 × 105个,离心去上清,用PBS洗2次,重悬细胞,加入Rhodamine123 (终浓度为0.5 mol/L),37℃温育20 min,预冷的PBS洗涤3次,用流式细胞仪测定细胞荧光强度(λex=480 nm,λem=530 nm),以Rhodamine 123荧光强度表示线粒体膜电位。
1.9 统计分析采用SAS统计软件进行分析;多组间均数比较用方差分析。
2 结果 2.1 实验大鼠成瘤情况实验结束时,正常对照组存活10只,解剖后未见肺部肿瘤形成。Ni2O3组存活7只,未见肺部肿瘤形成。Ni3 S2组存活6只,2只可见肺部肿瘤形成。肺部肿瘤组织学类型为低分化腺癌。
2.2 染镍大鼠肺泡细巨噬胞凋亡的形态学改变染镍组大鼠肺泡巨噬细胞可见凋亡的细胞体积小、细胞膜完整及细胞的染色质沿核内膜凝聚成类月牙状等细胞凋亡的形态改变。
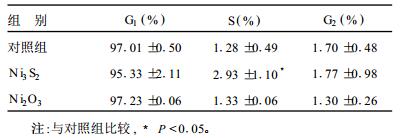
2.3 染镍大鼠巨噬细胞凋亡率(APO)、胞内游离Ca2+浓度和线粒体膜电位改变(表 1)| 表 1 镍对肺泡巨噬细胞细胞APO、胞内游离Ca2+浓度及线粒体膜电位的影响( x±s) |
从表 1可见,Ni3 S2组较对照组的凋亡率增加,线粒体膜电位变小,胞内游离钙浓度均增加(P < 0.05)。Ni2O3组较对照组的凋亡率和胞内游离钙浓度均增加,线粒体膜电位下降。
2.4 细胞周期的比较(表 2)| 表 2 染镍组与对照组大鼠AM细胞周期的比较( x±s) |
表 2提示,Ni3 S2组较对照组S期细胞比例明显增高(P < 0.05),其他期变化不明显。Ni2O3组与对照组各期细胞比例比较,差异均无统计学意义。
3 讨论本实验结果表明,这2组大鼠的存活率均较对照组降低,呈现毒性反应。在Ni3 S2组还见到肺部肿瘤的形成,Ni3 S2的致癌性强于Ni2O3。
研究发现,细胞凋亡的过程伴随胞质Ca2+的持续升高,可以通过多种方式介导细胞凋亡〔4, 5〕。本实验结果表明,和对照组比较,Ni3 S2组和Ni2O3组胞内游离钙浓度均增加,提示胞内外Ca2+的浓度梯度发生改变是造成大鼠巨噬细胞凋亡的可能原因。
研究表明,线粒体通透性转换(PT)孔在Ca2+依赖性的细胞凋亡中,通过使线粒体膜电位崩溃、大量Ca2+和凋亡诱导相关蛋白释放等方式调控细胞凋亡〔6, 7〕。本研究发现,Ni3 S2组和Ni2O3组均较对照组的线粒体膜电位变小。推测这很可能是引起细胞凋亡增加的重要原因。即线粒体膜电位下降可以导致PT孔开放,而线粒体PT孔开放可导致大量Ca2+外流,引起细胞内Ca2+浓度增加,从而引起线粒体电化学梯度的破坏、能量代谢异常,同时胞内钙的增加也诱导AM凋亡的发生。本研究发现,Ni3 S2组AM较对照组细胞S期百分比显著增高,S期发生阻滞,DNA损伤严重,也可能是Ni3 S2组AM凋亡率增高的原因之一。AM凋亡后,一方面吞噬、抗菌能力降低;另一方面使其抗原表达缺陷,抗原提呈功能受到抑制,利于肿瘤的发生。
| [1] | Denkhaus E, Salnikow K. Nickel essentiality, toxicity, and carcinogenicity[J]. Critical Reviews in Oncology/Hematology, 2002, 42 : 35–56. DOI:10.1016/S1040-8428(01)00214-1 |
| [2] | Alberg AJ, Brock MV, Samet JM. Epidemiology of lung cancer:looking to the future[J]. Clin Oncol, 2005, 23(14) : 3175–3185. DOI:10.1200/JCO.2005.10.462 |
| [3] | Ohmori T, Okada K, Terada M, et al. Low susceptibility of specificinbred colonies of rats to nickel tumorigenesis in soft tissue[J]. Cancer Letters, 1999, 136 : 53–58. DOI:10.1016/S0304-3835(98)00308-5 |
| [4] | Kass GE, Orrenius S. Calcium signaling and cytotoxicity[J]. Environ Health Perspct, 1999, 107 : 25–35. DOI:10.1289/ehp.99107s125 |
| [5] | Distelhorst CW, Dubyak G. Role of calcium in glucocorticosteroid-induced apoptosis of thymocytes and lymphoma cells:resurrection of old theories by new findings[J]. Blood, 1998, 91 : 731–734. |
| [6] | Susin SA, Zamzami N, Kroemer G. Mitochondria as regulators of apoptosis:doubt nomore[J]. Biochem Biophys Acta, 1998, 1366 : 151–165. |
| [7] | 白剑英, 孟紫强. 细胞凋亡抑制蛋白的研究进展[J]. 中国公共卫生, 2003, 19(6) : 761–763. |
 2009, Vol. 25
2009, Vol. 25

 , 石红军2
, 石红军2