已有报道, 膳食多不饱和脂肪酸(PUFA)中的n-3与n-6类型能明显影响血脂代谢〔1〕。目前联合国粮食农业组织(FAO)〔2〕提出脂肪酸n-3/n-6推荐量比值为1:5~1:10, 然而学术界至今对二者合理的比值仍有争论。有研究表明, PUFA改善高血脂至少部分是通过激活腺苷酸活化蛋白激酶(AMPK)〔3〕。有实验表明γ-亚麻酸比亚油酸降血脂效果更明显〔4, 5〕。本实验采用含γ-亚麻酸的琉璃苣油, 以大鼠为实验对象, 探索PUFA调节血脂代谢的作用机制。
1 材料与方法 1.1 材料 1.1.1 动物饲料基础饲料(美国农业部人类营养研究中心)配方参照文献〔6〕。高脂饲料配方参照文献〔7〕。高脂1:1, 1:5组分别由高脂饲料添加n-3/n-6为1:1, 1:5的油制得(本研究中n-3为亚麻酸油, 含60%α亚麻酸; n-6为琉璃苣油, 含20%γ亚麻酸, 40%亚油酸, 许昌元化生物科技有限公司); 低脂1:1, 1:5组采用基础饲料分别添加n-3/n-6为1:1, 1:5的油制得。饲料中n-3与n-6总量按成人推荐摄入量上限折算成大鼠推荐量, 再以其5倍为多不饱和脂肪酸降血脂总剂量, 即PUFA总量为6.67 g/kg。
1.1.2 动物分组58只清洁级雄性5~6周龄Sprague-Dawley (SD)大鼠(第四军医大学实验动物中心), 体重180~220 g。
1.1.3 主要仪器与试剂总胆固醇(T-CHO)测定试剂盒、甘油三酯(TG)测定试剂盒、低密度脂蛋白胆固醇(LDL-C)测定试剂盒(上海荣盛生物科技技术有限公司)。UV 2450紫外可见分光光度计(日本岛津公司); RNA裂解液、SYBR PrimesScript反转录聚合酶链式反应(RT-PCR)试剂盒(大连宝生物工程有限公司); Bio-IQ5实时PCR仪(美国BIO-RAD公司)。
1.2 方法 1.2.1 动物分组及处理大鼠适应性喂养1周后, 尾静脉采血测得血清总胆固醇(TC)水平后随机分为6组, 分别为:空白对照组9只, 高脂对照组9只, 高脂1:1组10只, 高脂1:5组10只, 低脂1:1组10只, 低脂1:5组10只。实验期为45 d。大鼠单笼喂养, 饮去离子水, 根据体重给予不同需要饲料, 记录进食量和体重变化。于实验前1 d, 第15, 30 d尾静脉取血, 于37℃水浴30 min, 4 000 r/min离心分离血清, 测定TG、TC、LDL-C水平。实验第45 d时, 禁食12 h, 乙醚麻醉后处死大鼠, 迅速取肝脏, 用生理盐水冲洗, 滤纸拭干, 冻存于液氮中备测mRNA。取皮下脂肪、腹膜下脂肪、睾周脂肪、肾周脂肪分别称重, 计算脂体比。
1.2.2 血脂指标测定具体操作步骤参照试剂盒说明书。
1.2.3 RNA分析取适量肝组织加入1ml RNA裂解液冰浴匀浆, 提取总RNA.经紫外可见分光光度计测定RNA浓度后, 反转录成cDNA, 进行2步法实时定量RT-PCR定量分别检测肝中PPAR-γ、AMPK-α2 mRNA表达水平。实时定量PCR以反转录产物为模板, 反应条件是:95℃ 10 s, 伴有40循环95℃ 5 s和65℃ 30 s。特异mRNA丰度计算为目标基因Ct/β肌动蛋白(β-actin) Ct的比率。引物序列为:PPAR-γ上游5'-GCTCTATCCCTGCTCGTGTG -3'下游5'-TTGATGTAGTGTCGCAGAGC-3'; AMPK-α2上游5'-TTTACCTGGTTGACAATCGGAGCTA-3'下游5'-AATCGACACTTGACCGAGGTCTG-3'; β-Actin上游5'-TCACCCACACTGTGCCCATCTA-3'下游5'-CATCGGAACCGCTCATTGCCGA-3'。
1.3 统计分析应用SPSS 13.0统计软件进行单因素方差分析(One Way-ANOVA)。
2 结果 2.1 实验前各组情况实验前各组大鼠TC、TG、LDL-C、体重和脂体比以及AMPK-α2和PPAR-γmRNA表达量之间差异均无统计学意义, 组间均衡。
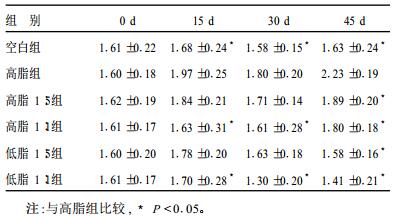
2.2 不同n-3/n-6配比脂肪酸对大鼠TC影响(表 1)| 表 1 ·不同n-3/n-6配比脂肪酸对大鼠总胆固醇影响( x±s, mmol/L) |
实验第15, 30, 45 d, 高脂组TC水平均高于空白组、高脂1:1及低脂1:1组, 差异均有统计学意义(P < 0.05);第45 d时高脂1:5及低脂1:5组TC也低于高脂组, 差异均有统计学意义(P < 0.05)。可见PUFA对大鼠TC有明显改善, 且n-3/n-6为1:1比1:5作用更明显。
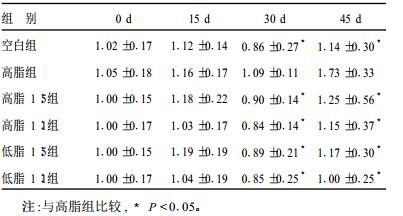
2.3 不同n-3/n-6配比脂肪酸对大鼠TG影响(表 2)| 表 2 不同配比脂肪酸膳食对大鼠TG影响( x±s, mmol/L) |
实验第30, 45 d, 高脂组TG水平均高于空白组和添加PUFA的4组, 差异均有统计学意义(P < 0.05)。可见PUFA对大鼠TG有明显改善, 且n-3/n-6为1:1比1:5作用更明显。
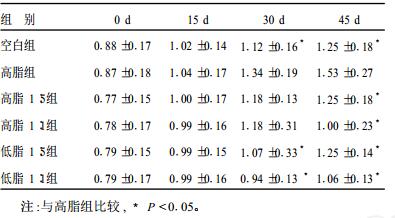
2.4 不同n-3/n-6配比脂肪酸对大鼠LDL-C影响(表 3)| 表 3 不同配比脂肪酸膳食对血清LDL-C影响( x±s, mmol/L) |
实验第30, 45 d, 高脂组LDL-C水平高于空白组、低脂1:1和低脂1:5组, 差异均有统计学意义(P < 0.05);第45 d时低脂1:1和低脂1:5组的LDL-C也低于高脂组, 差异均有统计学意义(P < 0.05)。可见PUFA对大鼠LDL-C有明显改善, 且n-3/n-6为1:1比1:5作用更明显。
2.5 不同n-3/n-6配比脂肪酸对大鼠体重、脂体比影响给予不同配比脂肪酸膳食45 d后, 各组动物体重都有所增加。高脂1:1、高脂1:5、低脂1:1、低脂1:5组大鼠体重分别为(408.94±12.41), (430.80±11.22), (391.30±7.85), (401.05±10.11) g, 与高脂组(452.42±10.68) g比较, 差异均有统计学意义(P < 0.05)。高脂1:5和低脂1:5组皮下脂肪比率分别为(1.04±0.12)%和(1.08±0.15)%, 与高脂组(1.23±0.16)%相比, 差异均有统计学意义(P < 0.05)。添加PUFA的4组腹膜下脂肪、睾周脂肪、肾周脂肪比率与高脂组比较, 差异均有统计学意义(P < 0.05);高脂1:1组睾周脂肪比率为(1.10±0.07)%, 与空白组比较, 差异有统计学意义(P < 0.05);高脂1:1组和低脂1:1组肾周脂肪比率分别为(1.09±0.06)%, (1.09±0.06)%, 与高脂组(1.18±0.05)%比较, 差异均有统计学意义(P < 0.05)。添加PUFA的4组脂体比分别为(4.18±0.10)%, (4.06±0.07)%, (4.15±0.08)%, (4.15±0.06)%, 与空白组(3.96±0.07)%和高脂组(4.60±0.06)%比较, 差异均有统计学意义(P < 0.05)。说明PUFA能够降低大鼠体重、体脂, 尤其是对降低内脏脂肪积累的作用明显。
2.6 大鼠肝组织AMPK-α2和PPAR-γ mRNA表达给予不同配比脂肪酸膳食45 d后, 添加PUFA的4组肝AMPK-α2 mRNA相对表达水平分别为(0.68±0.02)%, (0.53±0.023)%, (0.88±0.018)%, (0.57±0.019)%, 均低于空白组但均高于高脂组(0.34±0.022)%, 差异均有统计学意义(P < 0.05)。除高脂1:5和低脂1:5组之间差异无统计学意义外, 其他两两组间比较差异有统计学意义(P < 0.05)。肝PPAR-γmRNA表达水平除低脂1:1组的(0.97±0.024)%外, 高脂1:1、高脂1:5、低脂1:5组表达水平分别为(0.71±0.025)%, (0.55±0.021)%, (0.75±0.019)%, 均低于空白组表达水平; 但添加PUFA的4组均高于高脂组的(0.37±0.02)%, 差异有统计学意义(P < 0.05), 其他两两组间比较差异均无统计学意义。
3 讨论结果表明, 摄入PUFA能降低大鼠血脂水平, 减轻体重及体脂聚集, 机制可能是通过增加肝AMPK和PPAR-γmRNA表达发挥作用, 这与以往报道的PUFA对肝脂代谢和基因表达的影响一致〔8〕。PUFA, 特别是n-3与n-6配比为1:1的PUFA膳食能明显抑制胆固醇和甘油三酯形成, 与文献〔9〕结果一致。PUFA通过增加PPAR-γ表达从而增加脂肪酸氧化, 与Baillie等〔10〕的PUFA可激活参与脂肪酸氧化的基因PPAR、肉碱脂酰转移酶1(CPT-1)和乙酰辅酶A氧化酶(AOX)结果相一致。PPARγ可以使肝脏和肌肉组织中三酰甘油含量下降, 使代谢向有利方向转化〔11〕。PUFA增加PPARγ mRNA表达水平, 从而增加脂肪酸氧化。有研究表明, PUFA的所有这些效应可能是通过AMPK调节的〔3, 12〕。本结果表明, PUFA可以增加AMPK mRNA表达。AMPK的作用底物包括羟甲基戊二酸单酰辅酶A还原酶(HMG CoA)、乙酰辅酶A羧化酶(ACC)、激素敏感脂酶(HSL)、糖原合成酶等。AMPK在脂代谢中通过增加脂质氧化来促进三磷酸腺苷(ATP)的合成; 当ATP水平上升, AMPK则切断ATP的合成代谢途径, 有利于正常细胞能量平衡的建立〔12〕。但是由于脂肪代谢的变化是多种因素共同作用的结果, 因此, 要阐明PUFA影响大鼠血脂代谢的作用机制还需进一步研究。
| [1] | 张文斌, 季爱玲, 曹瑞, 等. 共轭亚油酸对肥胖大鼠脂肪组织瘦素的影响[J]. 中国公共卫生, 2005, 21(4) : 447–448. |
| [2] | 舒晓亮, 曹翔, 刘晓丽, 等. n-6/n-3脂肪酸配方油对大鼠血脂和脂质过氧化的影响[J]. 中国临床营养杂志, 2005, 13(4) : 232–237. |
| [3] | Suchankova G, Tekle M, Saha AK, et al. Dietary polyunsaturated fatty acids enhance hepatic AMP-activated protein kinase activity in rats[J]. Biochem Bioph Res Co, 2005, 326 : 851–858. DOI:10.1016/j.bbrc.2004.11.114 |
| [4] | Nakanishi T, Oikawa D, Koutoku T, et al. Gamma-linolenic acid prevents conjugated linoleic acid-induced fatty liver in mice[J]. Nutrition, 2004, 20 : 390–393. DOI:10.1016/j.nut.2003.12.014 |
| [5] | Schirmer MA, Phinney SD. Gamma-linolenate reduces weight regain in formerly obese humans[J]. The J Nutr, 2007, 137(6) : 1430–1435. |
| [6] | 王艳艳, 孙长颢, 董艳梅, 等. 断乳后低钙膳食对高脂膳食大鼠肥胖影响[J]. 中国公共卫生, 2007, 23(7) : 769–771. |
| [7] | 中华人民共和国卫生部. 保健食品检验与评价技术规范[M].2003版. 北京: 中华人民共和国卫生部, 2003: 35. |
| [8] | Xu J, Nakamura MT, Cho HP, et al. Sterol regulatory element binding protein-1 expression is suppressed by dietary polyunsaturated fatty acids.A mechanism for the coordinate suppression of lipogenic genes by polyunsaturated fats[J]. J Biol Chem, 1999, 274 : 23577–23583. DOI:10.1074/jbc.274.33.23577 |
| [9] | 时皎皎, 糜漫天, 韦娜, 等. 不同脂肪酸构成比对大鼠血脂影响的研究[J]. 第三军医大学学报, 2007, 29(9) : 824–827. |
| [10] | Baillie RA, Takada R, Nakamura M, et al. Coordinate induction of peroxisomal acyl-CoA oxidase and UCP-3 by dietary fish oil:a mechanism for decreased body fat deposition[J]. Prostaglandins Leukot Essent Fatty Acids, 1999, 60 : 351–356. DOI:10.1016/S0952-3278(99)80011-8 |
| [11] | Yang WS, Jeng CY, Wu TJ, et al. Synthetic peroxisome proliferator activated receptor-gamma agonist, rosiglitazone, and increases plasma levels of adiponectin in type 2 diabetic patients[J]. Diabetes Care, 2002, 25(2) : 376–380. DOI:10.2337/diacare.25.2.376 |
| [12] | Hardie DG, Carling D, Carlson M. The AMP-activated/SNF1 protein kinase subfamily:metabolic sensors of the eukaryotic cell?[J]. Annu Rev Biochem, 1998, 67 : 821–855. DOI:10.1146/annurev.biochem.67.1.821 |
 2009, Vol. 25
2009, Vol. 25