2. 浙江省杭州市疾病预防控制中心
铅对人体危害极为广泛, 铅暴露能使细胞活性氧增加, 破坏机体氧化/抗氧化动态平衡, 改变抗氧化酶活性及脂质过氧化水平, 从而导致细胞氧化损伤[1-3]。儿童因铅中毒导致不同程度智力下降也已成为目前严重的公共卫生问题之一。中药富含多种功能性化学成分, 在调节人体机能的同时可防止铅吸收, 促进铅排泄[4]。五味消毒饮源自《医宗金鉴》, 由金银花、野菊花、蒲公英、紫花地丁、紫背天葵组成, 具有清热解毒, 消散疖疮等功效[5]。本研究以染铅小鼠为试验对象, 观察五味消毒饮的排铅效果及对小鼠肝脏、脑组织氧化损伤的影响。
1 材料与方法 1.1 材料 1.1.1 试剂二巯基丁二酸(meso-2, 3-dimercaptosuccinic acid, DMSA; 美国Sigma公司); 硝酸(GR, 浙江中星化工试剂有限公司); 还原型谷胱甘肽(GSH)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)检测试剂盒(南京建成生物工程研究所)。
1.1.2 仪器UV751紫外可见分光光度计(上海分析仪器总厂); Z-2000偏振塞曼原子吸收光谱仪(日本Hitachi公司); GL-12B高速冷冻离心机(上海安亭科学仪器厂)。
1.1.3 五味消毒饮药液制备参考文献[5]方法, 制成0.5 g/ml (以生药计)的药液。
1.1.4 动物清洁级雄性ICR小鼠, 体重(14±2) g (浙江中医药大学动物实验中心)。
1.2 方法 1.2.1 动物分组及处理70只雄性ICR小鼠随机分为7组:正常对照组、五味消毒饮对照组、模型对照组、阳性药物(DMSA)对照组及五味消毒饮低、中、高剂量实验组。前20 d, 除正常对照组、五味消毒饮对照组外, 其余各组每隔1 d腹腔注射1次醋酸铅(20 mg/kg)[6]; 随后10 d, 正常对照组、模型对照组每天灌胃去离子水, 五味消毒饮对照组每天灌胃五味消毒饮药液(5 g/kg, 以生药计), DMSA组每天灌胃DMSA混悬液(70 mg/kg), 低、中、高剂量五味消毒饮组每天灌胃五味消毒饮药液(2, 5, 10 g/kg, 以生药计)。每天观察动物外观、体征、行为活动等, 每周记录体重2次。末次给予受试物后禁食不禁水24 h, 快速取血(肝素抗凝)、肝脏(分为2部分, 用于金属测定和脂质过氧化测定)、左脑和右脑, 全血、左脑及部分肝脏4℃保存, 右脑及剩余肝脏-70℃保存。
1.2.2 血液及组织中铅、锌、铜含量的测定取1.0 ml全血、左脑、部分肝脏, 分别加混合酸进行湿法消化, 用0.5 mol/L HNO3溶解残渣, 定容, 石墨炉原子吸收分光光度法测铅含量, 火焰法测锌、铜含量。
1.2.3 肝脏、脑组织脂质过氧化指标的测定取右脑及剩余肝脏, 按试剂盒要求制备组织匀浆并测定GSH、MDA含量和GSH-Px、SOD、CAT活性。
1.3 统计分析采用SPSS 13.0软件进行方差分析。
2 结果 2.1 受试物对小鼠行为及体重的影响试验期间, 小鼠活动无异常。实验结束时, 中、高剂量五味消毒饮组〔(22.90±2.19), (23.38±2.32) g〕小鼠体重增长略高于模型对照组〔(20.00±2.21) g〕, 与正常对照组〔(22.63±1.90) g〕相近; 染铅小鼠肝体比重系数增大〔(4.10±0.38)%〕, 给予五味消毒饮后可使其下降〔(3.87±0.39)%〕, 部分恢复到正常水平〔(3.84±0.44)%〕, 但差异均无统计学意义(P > 0.05)。
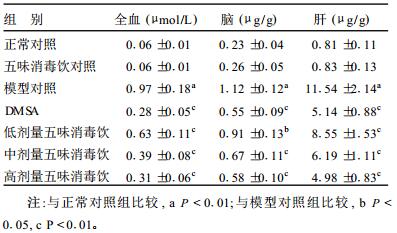
2.2 受试物对小鼠体内铅含量的影响(表 1)| 表 1 受试物对小鼠全血和肝、脑组织中铅含量的影响(x±s, n=10) |
从表 1可见, 模型对照组小鼠全血及肝脏、脑组织中铅浓度均高于正常对照组, 差异有统计学意义(P < 0.01), 说明造模达到良好效果。低、中、高剂量五味消毒饮组小鼠全血铅、肝铅和脑铅含量均显著降低, 且高剂量组全血及组织铅含量与DMSA组比较, 差异无统计学意义(P > 0.05)。
2.3 受试物对小鼠体内锌、铜含量的影响测定结果表明, 与正常对照组及模型对照组相比, 低、中、高剂量五味消毒饮组和DMSA组小鼠体内锌、铜含量差异均无统计学意义(P > 0.05), 说明受试物对小鼠体内的锌、铜含量均无不良影响。
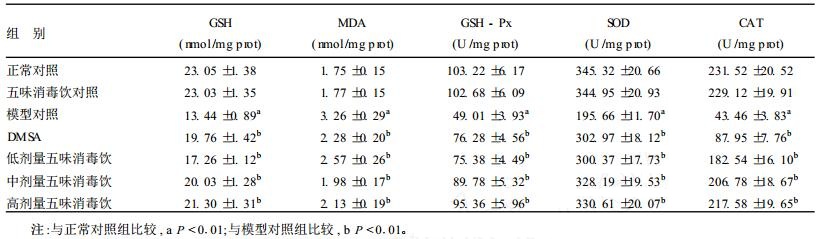
2.4 小鼠肝脏脂质过氧化指标测定结果(表 2)| 表 2 受试物小鼠肝脏脂质过氧化指标影响(x±s, n=10) |
从表 2可见, 与正常对照组相比, 模型对照组小鼠的肝脏GSH含量显著降低, MDA水平显著升高, GSH-Px、SOD和CAT活性明显下降。与模型对照组相比, 五味消毒饮可显著改善小鼠肝脏脂质过氧化, 增加组织抗氧化酶的活性。与DMSA相比, 中剂量五味消毒饮对MDA的生成有显著抑制作用, 而在中、高剂量时则可显著增加SOD、GSH-Px和CAT的活性。
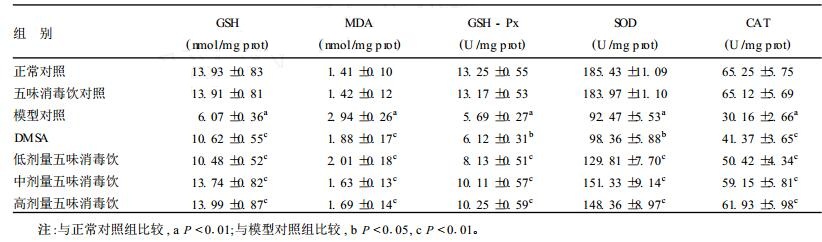
2.5 小鼠脑脂质过氧化指标测定结果(表 3)| 表 3 受试物小鼠脑脂质过氧化指标影响(x±s, n=10) |
从表 3可见, 与正常对照组相比, 模型对照组小鼠的脑GSH含量显著降低, MDA水平显著增加, GSH-Px、SOD和CAT活性显著下降, 说明模型对照组小鼠脑组织脂质过氧化作用增加, 诱导产生了氧化损伤。与模型对照组相比, 五味消毒饮可显著改善小鼠脑脂质过氧化, 增加GSH-Px、SOD和CAT的活性。与DMSA相比, 中、高剂量五味消毒饮对MDA的生成有显著抑制作用, 而在低、中、高剂量时则可显著增加SOD、GSH-Px和CAT的活性及GSH含量。
3 讨论研究证实, 氧化应激在铅毒性机制中发挥了重要作用, 铅能使细胞活性氧增加, 破坏机体抗氧化防御体系, 改变抗氧化酶活性及脂质过氧化水平, 从而导致细胞氧化损伤[1-3]。当前, 国内外在排铅药物及拮抗铅中毒造成的氧化损伤方面研究进展缓慢, 常用的药物主要有DMSA、单异戊基DMSA、依地酸钙钠等, 但患者在使用这些化学药物时经常出现恶心、呕吐、急性肾功能衰竭、消耗必需金属元素等副作用, 甚至引起休克和死亡, 严重影响了铅中毒的治疗, 尤其是儿童铅中毒的早期预防和治疗[1, 3, 6]。
本实验观察到, 低、中、高五味消毒饮组小鼠体重增长率均高于模型对照组和DMSA组, 且接近于正常对照组, 说明该中药复方的安全性较高; 五味消毒饮具有良好的排铅效果, 且对机体必需微量元素-锌、铜含量无不良影响。在正常情况下, 机体内GSH-Px、SOD、CAT及GSH等抗氧化物质可有效清除自由基, 维持细胞氧化/抗氧化动态平衡; MDA是脂质过氧化的分解产物, 其含量常常反映机体组织内脂质过氧化的程度〔2, 8-9〕。本研究发现, 染铅小鼠肝脏、脑组织中MDA水平显著升高, GSH含量及GSH-Px、SOD、CAT活性显著下降, 与国内外报道基本一致[1, 6-9]。MDA含量急剧升高, 提示小鼠体内脂质过氧化加剧; 而GSH含量及GSH-Px、SOD、CAT活性的下降, 提示大剂量的铅在小鼠体内持续积累, 使小鼠出现铅中毒。本实验结果表明, 五味消毒饮不仅具有良好的排铅效果, 还能有效改善染铅小鼠肝脏和脑组织的脂质过氧化状况, 且在一定程度上优于阳性对照药物DMSA, 其作用机制还有待于进一步研究。
| [1] | Pande M, Mehta A, Pant BP, et al. Combined administration of a chelating agent and an antioxidant in the prevention and treatment of acute lead intoxication in rats[J]. Environ Toxicol Phar, 2001, 9(4) : 173–184. DOI:10.1016/S1382-6689(01)00064-3 |
| [2] | Bokara KK, Brown E, McCormick R, et al. Lead-induced increase in antioxidant enzymes and lipid peroxidation products in developing rat brain[J]. Biometals, 2008, 21(1) : 9–16. DOI:10.1007/s10534-007-9088-5 |
| [3] | 李君, 潘家荣, 魏益民. 铅镉联合作用对大鼠肾脏脂质过氧化影响[J]. 中国公共卫生, 2007, 23(8) : 957–958. |
| [4] | 李伟, 范广勤. 杭白菊复合饮驱铅效果评价[J]. 中国公共卫生, 2007, 23(11) : 1380–1381. |
| [5] | 黄水仙, 田道法, 江志超. 五味消毒饮治疗大鼠实验性急性鼻咽炎的疗效观察[J]. 中国中西医结合耳鼻咽喉科杂志, 2006, 14(1) : 11–13. |
| [6] | Zhang J, Wang XF, Lu ZB, et al. The Effects of meso-2, 3-dimercaptosuccinic acid and oligomeric procyanidins on acute lead neurotoxicity in rat hippocampus[J]. Free Radical Bio Med, 2004, 37(7) : 1037–1050. DOI:10.1016/j.freeradbiomed.2004.06.037 |
| [7] | 胡秀丽, 荣会, 陈明岩, 等. 铅中毒对大鼠体内锌含量影响[J]. 中国公共卫生, 2007, 23(4) : 477–478. |
| [8] | Flora SJ, Saxena G, Gautam P, et al. Response of lead-induced oxidative stress and alterations in biogenic amines in different rat brain regions to combined administration of DMSA and MiADMSA[J]. Chem-Biol Interact, 2007, 170(3) : 209–220. DOI:10.1016/j.cbi.2007.08.003 |
| [9] | Shalan MG, Mostafab MS, Hassounab MM, et al. Amelioration of lead toxicity on rat liver with vitamin C and silymarin supplements[J]. Toxicology, 2005, 206(1) : 1–15. DOI:10.1016/j.tox.2004.07.006 |
 2009, Vol. 25
2009, Vol. 25