2. 吉林大学基础医学院医学遗传学教研室;
3. 吉林省长春市急救中心
中药白头翁为毛莨科多年生草本植物白头翁的干燥根〔1〕, 主要含有三萜皂苷、三萜酸、木脂素、白头翁灵、白头翁英、白头翁素、原白头翁素、胡萝卜苷以及糖蛋白等成分〔2〕。为观察其对机体免疫功能的作用进行了本研究。结果报告如下。
材料与方法(1)白头翁水提物(PWE):白头翁100g (吉林天益堂大药房); 粉碎后加入500 ml蒸馏水, 浸泡30 min, 在烧杯中反复煎煮3次, 收集药液, 过滤去渣, 浓缩至相当于50倍临床常用剂量, 4℃冰箱保存待用。(2)试剂与仪器:环磷酰胺(CP) (江苏恒瑞医药股份有限公司), 刀豆蛋白A (ConA); 大肠埃希菌脂多糖(LPS); 四甲基偶氮噻唑兰(MTT) (美国Sigma公司); 二甲基亚砜(DMSO)(北京化工厂); YAC-1细胞株(吉林大学基础医学院免疫教研室); Multiskan全自动酶标仪(美国Biorad公司)。(3)实验动物与分组:封闭群昆明种小鼠32只, 体重18~22 g, 雌雄各半(吉林大学实验动物中心)。随机分成4组:阳性对照组、PWE组、PWE+CP组、阴性对照组, 每组8只。根据预实验确定PWE最佳实验剂量为50倍人临床常用剂量, 阳性对照组、PWE+CP组动物于灌胃6 d后, 用CP腹腔注射连续5 d, 浓度40 mg/(kg·bw)。各组暴露条件:温度18~22℃, 湿度50~60%。(4)淋巴细胞转化能力试验:无菌制备小鼠脾细胞悬液, 洗涤1次, 1500 r/min离心5 min, 分别进行T淋巴细胞转化实验和B淋巴细胞增殖实验。其中T淋巴细胞转化实验用含10%小牛血清的RPMI-1640培养液, B淋巴细胞增殖实验用含10%小牛血清的I MDM培养液, 分别配成1×107/ml的细胞悬液; 分别加入96孔细胞培养板内, 每孔100 μl, 每个样品加6个复孔, 3复孔为试验孔, 3复孔为对照孔。其中T淋巴细胞转化实验的试验孔每孔加入终浓度为10 μg/ml的刀豆蛋白(ConA)各100 μl, B淋巴细胞增殖实验的试验孔每孔加入终浓度为10μg/ml的脂多糖(LPS) 100 μl; 对照孔均每孔加培养液100 μl; 分别于5% CO2培养箱中37 ℃培养48 h后, 每孔加入10 μlMTT溶液(5 mg/ml), 继续培养4 h; 吸去上清, 加入二甲基亚砜(DMSO) 100 μl/孔, 37℃孵育2 h, 待颗粒完全溶解后, 分别进行全自动酶标仪比色分析(A570)。分别用T淋巴细胞和B淋巴细胞刺激指数进行比较。(5)自然杀伤细胞(NK)活性测定:分组及脾细胞悬液制备同上, 调整悬液细胞浓度为1×107/ml。实验前24 h将靶细胞(YAC-1细胞)进行传代培养, 用IMDM培养液调整细胞浓度为2×105/ml。取靶细胞(YAC-1细胞)和效应细胞(脾细胞)各100 μl (效靶比为50:1), 加入96孔培养板中, 设效应细胞组、靶细胞组和实验组(脾细胞和YAC-1细胞, 每孔各100 μl), 各组均设3复孔, 于37℃ 5% CO2孵箱中培养24 h后, 每孔加入10 μlMTT溶液(5 mg/ml), 继续培养4 h, 然后弃上清, 加入DMSO 100 μl/孔, 轻轻振荡培养板, 使颗粒完全溶解, 全自动酶标仪进行比色分析(A570)。NK细胞活性按以下公式计算:NK细胞活性%=[1-(A实验组-A效应组)]/A靶细胞组×100%。(6)采用SPSS 11.5软件进行t检验。
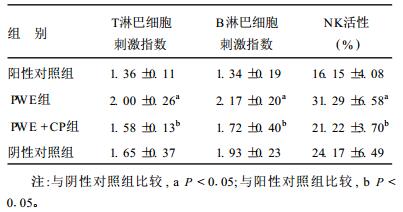
结果(1)白头翁水提物对淋巴细胞转化能力的作用:白头翁水提物可明显提高小鼠脾细胞对刀豆蛋白A (ConA)以及大肠埃希菌脂多糖(LPS)的反应性, 刺激小鼠脾脏的T、B淋巴细胞转化增殖, 对抗环磷酰胺(CP)对机体的免疫抑制作用。(2)白头翁水提物对自然杀伤细胞(NK)活性的作用白头翁水提物能显著提高小鼠自然杀伤细胞(NK)的活性, 对抗CP对NK细胞活性的抑制作用(表 1)。
| 表 1 PWE对小鼠T、B淋巴细胞增殖、NK细胞活性的影响( x±s) |
讨论
本文结果显示, 白头翁水提物(PWE)可使ConA激活的T淋巴细胞增殖反应明显增强, 还可明显提高小鼠脾细胞对LPS的反应性, 刺激B淋巴细胞增殖, 对抗CP造成的免疫抑制作用。自然杀伤细胞(NK)是细胞免疫中的非特异性成分, 是机体抵御感染和防止细胞恶性转化的重要免疫调节和免疫监视细胞〔4-9〕。CP可以降低NK细胞的杀伤活性。本文结果表明, PWE可以明显提高小鼠NK细胞的杀伤活性, 对抗CP引起的活性降低。其免疫增强作用可能是通过释放多种免疫调节细胞因子, 参与机体的免疫调节, 同时通过介导抗体依赖的细胞毒作用, 提高机体的防御能力。本文结果提示, PWE可以显著增强T、B淋巴细胞、NK细胞活性, 能够增强机体的特异性和非特异性免疫功能。
| [1] | 《中华本草》编委会. 中华本草精选[M]. 北京: 国家中医药管理局, 1998: 538. |
| [2] | 钟长斌, 李祥. 白头翁的化学成分及药理作用研究述要[J]. 中医药学刊, 2003, 21(8) : 1338. |
| [3] | 李凡, 刘永茂. 基础医学实验教程[M]. 北京: 高等教育出版社, 2002: 78-80. |
| [4] | 陈慰峰. 医学免疫学[M]. 北京: 人民卫生出版社, 2004: 295. |
| [5] | 杨丽云, 林美雄, 罗敏, 等. 低剂量辐射对NK细胞生物学活性的影响[J]. 放射免疫学杂志, 2006, 19(6) : 530–534. |
| [6] | Farag SS, VanDeusen JB, Fehniger TA, et al. Biology and clinical impact of human natural killer cells[J]. Int J Hematol, 2003, 78(1) : 7–17. DOI:10.1007/BF02983234 |
| [7] | Mehta SK, Kaur I, Grimm EA, et al. Decreased nonMHC-restricted (CD56+) killer cell cytotoxicity after spaceflight[J]. J ApplPhysiol, 2001, 91(4) : 1814–1818. |
| [8] | Chiorean EG, Miller JS. The biology of natural killer cells and implications for therapy of human disease[J]. J Hematother Stem Cell Res, 2001, 10(4) : 451–463. DOI:10.1089/15258160152509073 |
| [9] | Orange JS. Humannatural killer cell deficiencies and suscep tibility to infection[J]. Microbes and Infect, 2002, 4(15) : 1545–1558. DOI:10.1016/S1286-4579(02)00038-2 |
 2009, Vol. 25
2009, Vol. 25