2. School of Medicine, Health Policyand Practice, University of EastAnglia, Norwich NR47 TJ, UK
流行病学研究显示,食用十字花科蔬菜丰富的膳食可以降低多种癌症的发病率,目前认为其功效成分主要为类植物中普遍存在的异硫氰酸盐(isothiocyanates, ITCs)〔1, 2〕。ITCs可通过诱导解毒酶/抗氧化物酶,促进化学致癌物的代谢清除,同时增强机体的抗氧化防御机能〔3, 4〕。硫氧还蛋白还原酶(thioredoxin reductase, TR)是机体重要的抗氧化防御系统酶类,并参与到许多重要的细胞内、外生物学过程〔5〕。本研究探讨了ITCs类植物化学物莱菔硫烷(sulforaphane, SFN)对人肝细胞系HHL-5中TR1的诱导作用及其机制,旨在为我国居民提出增加十字花科蔬菜摄入的合理建议,并为今后ITCs类抗肿瘤药物的开发提供理论依据。
1 材料与方法 1.1 细胞HHL-5细胞为DrArvind Patel (MRC Virology Unit, Glasgow, UK)所赠,为人原代肝细胞在莫洛尼小鼠白血病病毒作用下诱导的永生化肝细胞。
1.2 主要试剂SFN,二甲基亚砜(DMSO),Real-time RT-PCR反应引物和探针及GenEluteTM Total Mammalian RNA Kit (美国Sigma公司);WST-1(德国Roche公司);抗体(美国Santa Cruz公司);CelLyticTM NuCLEARTM Extraction Kit (美国Chemicon公司);TaqMan one-step RT-PCR Master Mix Reagents (美国ABI公司)。
1.3 主要仪器ABI 7500 Fast Real-Time PCR System (美国ABI公司);Nanodrop spectrophotomenter (美国Labtech公司);蛋白电泳槽及胶架(美国Bio-Rad公司)。
1.4 实验方法 1.4.1 细胞培养HHL-5细胞培养在含10%胎牛血清、2 mmol/L谷氨酰胺、100 U/ml青霉素、100 μg/ml链毒素的Dulbecco's MEM改良培养液(DMEM)中,并置于5% CO2、37 ℃的孵箱中孵育。每2 d换1次液,每星期传代1次。
1.4.2 细胞增殖试验HHL-5细胞接种到96孔板,达70%~80%融合后以DMSO为对照,加0,20,40,60,80 μmol/L浓度SFN处理24 h。然后每孔中加入10 μl WST-1试剂,孵箱中孵育2 h,振荡混匀1 min,读取吸光值,测定波长为450 nm,参照波长为63 nm。
1.4.3 蛋白提取及免疫蛋白印迹(Western blotting)蛋白提取按CelLyticTM NuCLEARTM Extraction Kit (美国Chemicon公司)操作手册;Western blotting操作按Svehlíková V文献〔6〕方法。
1.4.4 总RNA提取及定量总RNA提取方法按GenEluteTM Total Mammalian RNA Kit (美国Sigma公司)操作手册。纯化后的RNA立即加入RNA酶抑制剂,并应用Nanodrop进行RNA含量和纯度测定,当A260/A280的比值介于1.8~2.1时方可用于试验,并分装保存于-80 ℃。
1.4.5 TR1 mRNA定量TR1 mRNA通过ABI 7500 Fast Real-Time PCR system测定,先根据TR1序列(Genbank accession number AF208018), 应用Primer Express设计引物和探针。TR1:Forward primer:5′-CCACTGGTGAAAGACCACGTT-3′, Reverse primer:5′-AGGAGAAAAGATCATCACTGCTGAT-3′,Probe:5′-CAGTATTCTTTGTCACCAGGGATGCCCA-3′。反应参数为48 ℃ 30 min逆转录、95 ℃ 10 min的AmpliTapTM gold activation、40个PCR循环(95 ℃ 15 s变性,60 ℃ 1 min退火/延伸)。内对照为18 s,试验结果通过ΔΔCt法将TaqMan
应用SPSS统计软件进行分析,多组间比较采用方差分析。
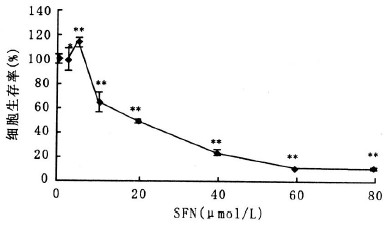
2 结果 2.1 SFN对HHL-5细胞增殖作用的影响(图 1)
|
注:与DMSO对照组比较,*P < 0.05,**P < 0.01。 图 1 SFN处理HHL-5细胞24 h后对细胞生存率的影响 |
如图 1所示,5 μmol/L SFN处理HHL-5细胞24 h,促进了细胞生长,细胞生存率为113.17%;更高剂量则导致生长抑制,10,20,40及60 μmol/L SFN处理后,细胞生存率分别为63.21%,46.33%,18.8%及4.69%。确定SFN对HHL-5细胞24 h的半数抑制浓度(IC50)为16.5 μmo/L。因此,在观察SFN对TR1的诱导作用时,选择的剂量不高于20 μmol/L。
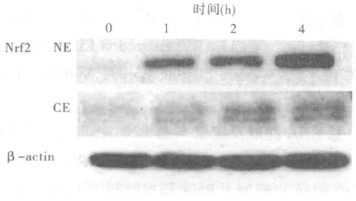
2.2 SFN对HHL-5细胞Nrf 2蛋白表达的诱导(图 2)
|
图 2 20 μmol/L SFN处理HHL-5细胞不同时间对Nrf 2的影响 |
20 μmol/L SFN处理HHL-5细胞0,1,2及4 h后分别提取胞浆和胞核蛋白,观察SFN对转录因子Nrf 2的诱导作用。如图 2所示,无论是在胞浆(CE)还是胞核(NE),SFN对Nrf 2的诱导均呈明显的时间依赖性,但胞核内的密度值远高于胞浆。在细胞核内,对照组即稳态水平的Nrf 2表达极为微弱,而20 μmol/L SFN处理HHL-5细胞1 h后,Nrf 2的表达就明显增加,并且这种诱导持续递增到处理4 h。
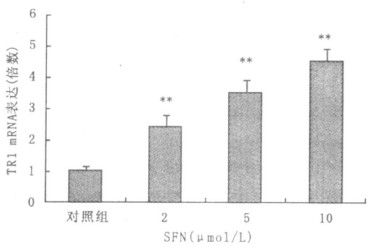
2.3 SFN对HHL-5细胞TR1 mRNA的诱导(图 3)
|
注:与对照组比较,** P < 0.01。 图 3 SFN处理HHL-5细胞24 h后对TR1 mRNA的诱导 |
图 3所示,不同剂量SFN处理HHL-5细胞24 h后,对TR1 mRNA的诱导呈明显的剂量依赖效应。2,5及10 μmol/L SFN对TR1 mRNA的诱导分别为对照组的2.4,3.6和4.6倍。
3 讨论SFN是目前最受关注的一种ITCs,它在绿花椰菜中含量较为丰富。本研究发现,不同剂量的SFN处理HHL-5细胞24 h,对细胞生长的影响表现为双向调节作用。低剂量的促生长作用可能是由于SFN代偿性诱导机体防御系统酶类表达〔1〕;而高剂量的生长抑制作用则可能源于过度的氧化应激所致失代偿性细胞凋亡〔7〕。
ITCs可诱导机体防御系统酶类表达,而这些酶类mRNA的5′侧翼序列中普遍含有抗氧化反应元件(antioxidant response element, ARE)。研究证实,核因子E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf 2)是激活ARE的特异性转录因子〔8〕。稳态情况下,Nrf 2通过与其抑制剂(Kelch-like ECH-associated protein 1, Keap1)结合,被锚定在胞浆中,并通过泛素化蛋白酶通路降解〔9, 10〕。而诱导物如ITCs及茶多酚等促进Nrf 2-Keap1解偶联,Nrf 2随后进入胞核并激活ARE调控基因的转录诱导〔11, 12〕。本研究发现,SFN处理HHL-5细胞24h后,TR1转录呈剂量依赖性递增,而Nrf 2在TR1转录前即表现为明显的时间依赖性核聚集趋势,考虑到TR1的5′侧翼序列中所具有的ARE,推测在SFN诱导HHL-5细胞TR1转录过程中可能是涉及到了Nrf 2-ARE通路所介导的转录激活。结果提示,在膳食中增加十字花科蔬菜的摄入量,可诱导包括TR1在内的防御系统酶类表达,从而对氧化损伤相关的疾病发生、发展起到预防和保护作用。
| [1] | Zhao H, Lin J, Grossman HB, et al. Dietary isothiocyanates, GSTM1, GSTT1, NAT2 polymorphisms and bladder cancer risk[J]. Int J Cancer, 2007, 120(10) : 2208–2213. DOI:10.1002/ijc.v120:10 |
| [2] | Rask L, Andréasson E, Ekbom B, et al. Myrosinase:gene family evolution and herbivore defence in Brassicaceae[J]. Plant Mol Bio, 2000, 42(1) : 93–113. DOI:10.1023/A:1006380021658 |
| [3] | Zhang Y, Munday R, Jobson He, et al. Induction of GST and NQO1 in cultured bladder cells and in the urinary bladders of rats by an extract of broccoli (Brassica oleracea italica) sprouts[J]. J Agric Food Chem, 2006, 54(25) : 9670–9676. |
| [4] | 侯春彦, 张劲松. 莱菔硫烷脱毒和抗氧化功能研究进展[J]. 中国公共卫生, 2008, 24(5) : 626–628. |
| [5] | Papp LV, Lu J, Holmgren A, et al. From selenium to selenoproteins:synthesis, identity, and their role in human health[J]. Antioxid Redox Signal, 2007, 9(7) : 775–806. DOI:10.1089/ars.2007.1528 |
| [6] | Svehlíková V, Wang S, Jakubíková J, et al. Interactions between sulforaphane and apigenin in the induction of UGT1A1 and GSTA1 in CaCo-2 cells[J]. Carcinogenesis, 2004, 25(9) : 1629–1637. DOI:10.1093/carcin/bgh169 |
| [7] | Tang L, Zhang Y, Jobson HE, et al. Potent activation of mitochondria-mediated apoptosis and arrest in S and M phases of cancer cells by a broccoli sprout extract[J]. Mol Cancer Ther, 2006, 5(4) : 935–944. DOI:10.1158/1535-7163.MCT-05-0476 |
| [8] | Itoh K, Chiba T, Takahashi S, et al. An Nrf 2/small Maf heterodimer mediates the induction of phase Ⅱ detoxifying enzyme genes through antioxidant response elements[J]. Biochem Biophys Res Commun, 1997, 236(2) : 313–322. DOI:10.1006/bbrc.1997.6943 |
| [9] | Itoh K, Wakabayashi N, Katoh Y, et al. Keap 1 represses nuclear activation of antioxidant responsive elements by Nrf 2 through binding to the amino-terminal Nef 2 domain[J]. Genes Dev, 1999, 13(1) : 76–86. DOI:10.1101/gad.13.1.76 |
| [10] | Kobayashi A, Kang MI, Okawa H, et al. Oxidative stress sensor Keap 1 functions as an adaptor for Cul3-based E3 ligase to regulate proteasomal degradation of Nrf 2[J]. Mol Cell Biol, 2004, 24(16) : 7130–7139. DOI:10.1128/MCB.24.16.7130-7139.2004 |
| [11] | 钟敏. Nrf 2-Keap1抗氧化系统研究进展[J]. 中国公共卫生, 2006, 22(3) : 360–362. |
| [12] | Na HK, Surh YJ. Modulation of Nrf 2-mediated antioxidant and detoxifying enzyme induction by the green tea polyphenol EGCG[J]. Food Chem Toxicol, 2008, 46(4) : 1271–1278. DOI:10.1016/j.fct.2007.10.006 |
 2009, Vol. 25
2009, Vol. 25

 , 吴坤1
, 吴坤1