锰中毒主要影响神经系统,表现为类似帕金森综合征症状〔1〕。有研究表明,锰可导致细胞处于氧化应激态并引起细胞损伤〔2〕,亦可通过诱导细胞产生氧自由基,介导细胞变性进而引起细胞的凋亡或死亡〔3〕。但对细胞凋亡相关基因抑癌基因P53、原癌基因MDM2及蛋白产物的影响研究较少。本研究通过观察锰对PC12细胞凋亡的诱导作用及与凋亡相关的抑癌基因P53、原癌基因MDM2蛋白表达关系,探讨其凋亡诱导作用及机制。
1 材料与方法 1.1 主要试剂氯化锰(MnCl2·4H2O) (中国医药集团上海化学试剂公司);胎牛血清培养基(DMEM)(美国Giboc公司);胎牛血清(武汉洁洋盛生物试剂有限公司);鼠抗人单抗P53、MDM2抗体和卵白素-生物素过氧化物酶复合物(ABC)试剂盒(美国晶美生物有限公司)。
1.2 方法 1.2.1 细胞培养PC12细胞株(中科院细胞库上海细胞生物研究所)在含有10%胎牛血清、2 mmol/L谷氨酰胺、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基中,于37 ℃、5%CO2条件下培养。选取对数生长期、生长良好、细胞活性 > 98%的细胞用于实验。
1.2.2 细胞毒性检测采用四甲基偶氮噻唑蓝(MTT)比色法,检测对数生长期的PC12细胞。将氯化锰加入培养液使其终浓度为0,200,400,800 μmol/L MnCl2,调整细胞浓度为5×105/ml,接种于96孔培养板,每种剂量浓度为1组,每组设3个平行孔(n=3)表示,分别培养24,36,48 h后,将染毒培养细胞液弃掉,每孔加20 μl MTT,培养4 h, 弃MTT,加二甲基亚砜(DMSO)150 μl充分溶解15 min。选择490 nm波和长,酶联免疫检测仪上测定各孔吸光度(A)值表示。PC12细胞生长抑制率=(1-实验组平均A值/对照组平均A值)×100%。
1.2.3 细胞凋亡流式细胞仪检测用荧光素标记的膜联蛋白V (Annexin-V-FITC)及碘化丙啶(PI)双标流式细胞术检测细胞凋亡,取不同锰浓度染毒培养24 h的PC12细胞为检测对象,用70%乙醇固定12 h, 磷酸盐缓冲液(PBS)去固定液,离心弃上清。用结合缓冲液37 ℃孵育60 min,195 μl细胞悬液加5 μl Annexin-V-FITC,混匀,室温10 min。用缓冲液洗涤细胞1次,在190 μl结合缓冲液中重悬,然后再加入10 μl 20 μg/ml碘化丙啶(PI),流式细胞仪上检测。
1.2.4 原位缺口末端标记法检测细胞凋亡取染锰培养24 h的PC12细胞铺片,0.01 mol/L Tris缓冲液(TBS)洗涤,4%对聚甲醛室温固定30 min, TBS洗涤3 min×2次,按检测试剂盒说明制片,中性树脂封片,采用高清晰彩色医学图文分析系统HMIAS-2000型,每片取3个视野,测定其平均吸光度(A)值。
1.2.5 P53、MDM2蛋白表达免疫细胞化学法检测采用亲和素-生物素-酶复合物法(ABC)免疫酶染色法。取染锰培养24 h的PC12细胞铺片,PBS (0.01 mol/L,pH 7.4)冲冼2遍;75%酒精固定15 min,冷丙酮固定10 min;中性树脂封片,采用高清晰彩色医学图文分析系统HMIAS-2000型,每片取3个视野,测定其平均吸光度(A)值。
1.3 统计分析采用Excel建立数据库,应用SAS软件进行统计分析。
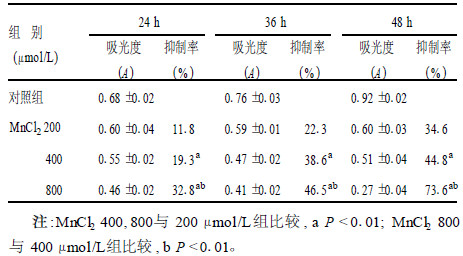
2 结果 2.1 锰对PC12细胞生长的影响(表 1)| 表 1 不同浓度MnCl2对PC12细胞生长抑制率(%, x±s, n=3) |
MnCl2对PC12细胞的生长具有明显的抑制作用,随着染毒剂量增加和染毒时间延长,其抑制作用增强,并呈时间剂量依赖性,各染毒组及同一剂量不同染毒时间组细胞抑制率差异均有统计学意义(P < 0.01)。
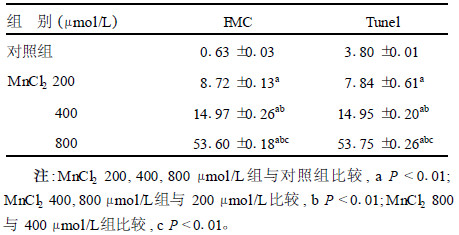
2.2 锰对PC12细胞凋亡的影响(表 2)| 表 2 不同浓度MnCl2染毒培养24 h PC12细胞凋亡率(%, x±s, n=3) |
Annexin-V-FITC及PI双标流式细胞术和Tunel法对PC12细胞凋亡检测结果显示,随着染锰浓度增大,细胞凋亡率逐渐增加,各组间及各组与对照组比较,差异均有统计学意义(P < 0.01)。
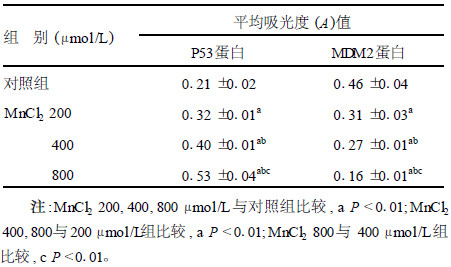
2.3 锰对PC12细胞P53、MDM2蛋白表达的影响(表 3)| 表 3 不同浓度MnCl2处理PC12细胞24 h后P53蛋白、MDM2蛋白表达情况(x±s, n=3) |
不同浓度MnCl2作用PC12细胞24 h后,对P53蛋白表达的影响呈浓度依赖性增强,对MDM2蛋白表达的影响呈浓度依赖性下降,各组间及各组与对照组比较,差异均有统计学意义(P < 0.01)。
3 讨论锰可以通过多种途径导致神经细胞发生退化性变化,但其机制较为复杂,尚不完全清楚。目前已有报道锰可诱导培养的PC12细胞凋亡〔4〕。本次对PC12细胞染锰体外实验发现,锰能有效的抑制PC12的增殖,诱导PC12细胞凋亡,并具有量效关系和时间依赖性,与文献〔5〕结果一致。
P53是抑癌基因,同时也是重要的促凋亡基因,其主要生物学作用是调控细胞周期和诱导细胞凋亡,维持基因组和细胞稳定,抑制肿瘤生长。MDM2为原癌基因,对细胞生长也有调节作用,其生物学作用是增强细胞的生存活力,使细胞生存期延长,促进细胞增生及肿瘤的生长。P53与MDM2之间有平衡关系,共同参与调控细胞生长。正常情况下,MDM2与P53之间形成反馈环调节,维持二者的稳定〔6〕。同时MDM2作为P53重要的下游基因,能与P53结合,抑制P53的功能,促进P53的降解〔7〕。野生型P53蛋白表达的增加和MDM2表达的下调是细胞凋亡的重要指标〔8, 9〕。本实验结果显示,MnCl2作用PC12细胞24 h后,P53蛋白的表达增强,MDM2蛋白的表达降低,并呈浓度依赖性,表明锰可以通过诱导多巴胺能神经元凋亡发挥其神经毒性作用。
P53蛋白表达的增高及MDM2蛋白表达的下调可能是其重要的作用机制之一,这为锰的神经毒性作用机制提供了一定的依据,但是细胞凋亡受诸多基因和蛋白的调控,有关锰的神经毒性作用机制与基因表达关系尚需进一步研究。
| [1] | Chen JY, Tsao GC, Zhao Q, et al. Differential cytotoxicity of Mn (Ⅱ) and Mn (Ⅲ):special reference to mitochondrial [Fe-S]containing enzymes[J]. Toxicol Appl Pharmacol, 2001, 175(2) : 160–168. DOI:10.1006/taap.2001.9245 |
| [2] | 吴萍, 张杰, 李洁, 等. 锰的神经毒性机制探讨[J]. 中国公共卫生, 2005, 21(7) : 800–802. |
| [3] | Schrantz N, Blanchard DA, Mitenne F, et al. Manganese induces apoptosis of human B cells:caspase-dependent cell death blocked by Bcl-2[J]. Cell Death Differ, 1999, 6(3) : 445–453. |
| [4] | 陈景元, 陈耀明, 骆文静. 锰对多巴胺能神经细胞PC12的毒性及其机制研究[J]. 卫生研究, 2002, 31(6) : 223–225. |
| [5] | 徐文, 陈景元, 王枫, 等. 锰诱导PC12细胞凋亡与P-38MAPKs的关系[J]. 中国公共卫生, 2004, 20(12) : 1527–1529. |
| [6] | Prives C. Signaling to P53:breaking the MDM2-P53 circuit[J]. Cell, 1998, 95(1) : 5–8. DOI:10.1016/S0092-8674(00)81774-2 |
| [7] | Haupt Y, Maya R, Kazaz A, et al. MDM2 promotes the rapid degradation of p53[J]. Nature, 1997, 387(6630) : 296–299. DOI:10.1038/387296a0 |
| [8] | Levine AJ, Momand J, Finlay CA. The P53 tumor suppressor gene[J]. Nature, 1991, 351(6326) : 453–456. DOI:10.1038/351453a0 |
| [9] | 黄国香, 吴青, 郭晓鹏, 等. 锰对HUVEC-304细胞生长及P53P21WAFI/CIPI蛋白表达的影响[J]. 中国工业医学杂志, 2006, 19(6) : 328–330. |
 2009, Vol. 25
2009, Vol. 25