抗-D抗体被广泛用于防止RhD同种免疫〔1, 2〕,同时也用于治疗特发性血小板减少性紫癜〔3, 4〕。目前临床使用的抗-D抗体均为经人为免疫而得的血源制剂〔5〕,而因妊娠等自然免疫而产生的获得性抗D抗体,由于其血液中含量少,未受到足够重视而加以利用。本文旨在探讨不同渗透浓度的磷酸盐缓冲液(PBS)对血影细胞的影响,以及探索用血影细胞从含低效价抗-D抗体的血浆中分离纯化该抗体的方法及其可操作性。
1 材料与方法 1.1 材料 1.1.1 主要试剂与仪器抗D含量为0.81 μg/ml、IgG含量为9.36 g/L的健康人血浆(贵州省血液中心);Rh表型为(CCDee)的O型红细胞(贵州省血液中心);效价为1:256的抗-D (IgG)血型抗体标准品(上海市血液中心);荧光素标记为兔抗人IgG (深圳晶美公司,试剂批号为040803,1.0 mg/ml);MININEPHTM人IgG试剂盒(英国The Binding site公司,生产编号为ZK004.R);99/728抗-D抗体标准品(英国生物标准和控制国家研究所);彩色IgG、IgA、IgM免疫单扩散板(上海捷门生物技术合作公司,批号040601);8200型超滤器、截留分子量30KD的超滤膜(美国Milipore分司);3K30型低温高速离心机(德国Sigma分司);FACSCabiber流式细胞仪(美国Becton Dickinson公司);高效液相色谱仪(美国Waters公司);MININEPSAN散射比浊仪(英国The Bingding Site公司)。
1.1.2 血影细胞的制备用等体积生理盐水对Rh表型为CCDee的O型红细胞洗涤离心3次(1 000 r/min×5 min,4 ℃);然后用pH 7.4,渗透浓度分别为40,30,20 mmol/L的PBS对其7次洗涤离心(20 000 r/min×15 min,4 ℃)至上清无色,沉淀即为含D抗原的血影细胞。
1.2 方法 1.2.1 血影细胞的形态和抗原性检测在光镜下观察血影细胞的形态。将20,30,40 mmol/L的PBS制备的血影细胞与标准抗-D抗体于37 ℃孵育30 min后,离心(4 000 r/min×5 min,4 ℃),取上清液,用RhD筛选细胞测定其抗体效价,标准抗-D抗体效价减去上清液效价的差值即可反映血影细胞的抗原性。在相同条件下重复检测5次。
1.2.2 血浆抗D-抗体的分离纯化血影细胞用2%戊二醛以2%戊二醛:血影细胞=2:1的体积比固定30 min后与血浆按1:2的体积比例混合,37 ℃轻柔搅拌2 h,然后4 ℃,1 000 r/min离心5 min,弃上清,沉淀的细胞用10倍体积的pH 2.8,0.2 mol/L的甘氨酸-盐酸缓冲液洗脱。然后常温下以1 000 r/min离心3 min,洗脱液用0.05 mol/L NaOH将pH调至6.0~6.5,在相同条件下重复2次,合并洗脱液,超滤浓缩至原血浆体积的1/5,过滤除菌,冷冻干燥,4 ℃保存。在相同条件下重复分离纯化7次。
1.2.3 终点散射比浊法测定IgG含量免疫单扩散法检测IgA和IgM含量;高效液相色谱法测定IgG单体加二聚体含量;流式细胞仪测定抗-D抗体含量;邻甲联苯胺法行血红蛋白(hemoglobin, Hb)定性测定,试管法测定抗A、抗B血型抗体。
1.3 统计分析采用SPSS12.0软件进行统计分析,组间差异用t检验。
2 结果 2.1 血影细胞形态用渗透浓度为20 mmol/L的PBS制备的血影细胞形态不规则,混有较多细胞碎片;用30,40 mmol/L的PBS制备的血影细胞均呈透明圆形,未见明显细胞碎片;但40 mmol/L的PBS制备的血影细胞内含有少量Hb,细胞中心可见红色。
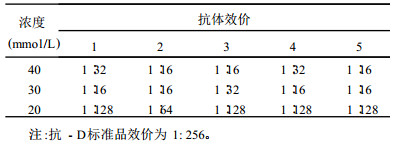
2.2 血影细胞的抗原性(表 1)| 表 1 标准抗体与血影细胞孵育后测定5次上清液中的抗体效价 |
用20 mmol/L的PBS制备的血影细胞与抗-D抗体标准品孵育后有4次上清液中的抗体效价为1:128,最高1次为1:64;而用30,40 mmol/L的PBS制备的血影细胞与抗-D抗体标准品孵育后,上清液中的抗体效价均在1:16与1:32之间。
2.3 制剂的IgG和抗-D抗体含量及其回收率用30 mmol/L PBS制备的血影细胞对血浆进行亲和层析得到的制剂中,IgG含量为(4.24±1.53) g/L (n=7),其中单体加二聚体占(99.9±0.25)%(n=7);抗-D抗体的含量为(3.45±0.31) μg/ml (n=7);抗-D抗体的回收率为(84.65±7.85)%(n=7);7次重复得到的制剂均不含抗A、抗B血型抗体以及IgA、IgM和Hb。
2.4 分离纯化过程对血影细胞的影响用30 mmol/L PBS制备的血影细胞在2%戊二醛固定并经亲和层析后细胞略变小,而经过洗脱液洗脱后的血影细胞比固定后的细胞形体稍大,但这两种方法处理后的细胞均呈完圆形,细胞涂片光镜下未观察到细胞膜的碎片。
3 讨论我们曾用柱层析法从低效价血浆中分离得到含抗-D抗体的IgG,再用经2%戊二醛固定的RhD阳性红细胞从IgG中纯化抗-D抗体。但由于历经柱层析和亲和层析2次分离纯化,抗-D抗体丢失较多,回收率仅约为72.6%。为提高抗-D抗体的回收率,直接用RhD阳性红细胞从含抗-D抗体的血浆中分离纯化该抗体。但经戊二醛固定30 min的红细胞与血浆接触后出现血红蛋白溢出现象,延长红细胞固定时间及灭活血浆补体均不能改善该现象。
鉴于RhD抗原仅分布于红细胞膜上,利用低渗裂解液将血红蛋白(Hb)从红细胞中释出Hb,成为具有D抗原性的血影细胞。鉴于30 mmol/L PBS,制备的血影细胞保持了较强的抗原性并且不带有Hb,应用此血影细胞与含低效价抗-D抗体的血浆进行亲和层析,成功分离了抗-D抗体,抗-D抗体回收率提高到了84.65%。同时制剂的总IgG量明显低于血浆中的含量,有不含抗A、抗B血型抗体以及IgM、IgA和Hb。
经过亲和层析,血影细胞的形态没有发生明显变化,提示有再利用的可能性。因此,用pH 7.4,30 mmol/L PBS将遗传表型为CCDee的O型红细胞制备为具有完整D抗原性的血影细胞,以此作为固相抗原与血浆进行亲和层析,可以从低效价血浆中分离纯化抗-D抗体,抗-D抗体的回收率较高,方法简单,有一定的可操作性。
| [1] | Jabara S, Barnhart KT. Is Rh immune globulin need in early first-trimester abortion? A review[J]. Am J Obstet Gynecol, 2003(3) : 623–627. |
| [2] | Augustson BM, Fong EA, Grey DE, et al. Postpartum anti-D:can we safely reduce the dose[J]. Med J Aust, 2006(12) : 611–613. |
| [3] | Fung KF, Eason E, Crane J, et al. Prevention of Rh alloimmunization[J]. J Obstet Gynaecol Can, 2003(9) : 765–773. |
| [4] | Ambriz-Fernandez R, Martinez-Murillo C, Quintana-Gonzalez S, et al. Fc recepteor blockade in patients with refractory chronic immune thrombocytopenic purpura with anti-D IgG[J]. Arch Med Res, 2002(6) : 536–540. |
| [5] | Kumar M, Vil TA, Johnson CS, et al. Treatment, outcome and cost of care in children with idiopathic thrombocytopenic purpura[J]. Am J Hematol, 2005(3) : 181–187. |
 2009, Vol. 25
2009, Vol. 25