2. 北京市中西医结合医院骨科;
3. 中山大学干细胞与组织工程研究中心
来源于中胚层的骨髓间充质干细胞(Mesenchymal stem cells, MSCs),具有自我更新能力和多项分化潜能〔1, 2〕,能对损伤组织和多器官、多系统的老化退行性变进行再生性修复,并且易于外源基因的转染和表达,已成为组织工程、细胞移植、基因治疗以及从干细胞角度进行抗衰老治疗和保健等方面的研究热点〔3, 4〕。但是,MSCs在成人的骨髓中含量仅占有核细胞的1/104~1/105,并随年龄的增加,细胞数量逐渐减少。所以,在体外大量扩增MSCs是干细胞应用亟待解决的问题。党参(Dang Shen,DS)是常用补中益气中药,作用同人参相似,可促进DNA的合成和糖解,有提高能量代谢和蛋白质合成作用,党参皂甙有促进细胞增殖和抗细胞凋亡作用〔5, 6〕。为此,本研究采用体外培养成人骨髓MSCs,探讨党参对MSCs增殖的影响。
1 材料与方法 1.1 材料成人肋骨来源于非血液系统疾病的胸外科手术中摘取的肋骨。低糖(L-DMEM)细胞培养液(美国GibcoBRL公司);FCS(foetal calf serum)胎牛血清(美国Hyclone公司);四甲基偶氮噻唑蓝(MTT)(美国Sigma公司);细胞分离液(Ficoll-Paque reagent)(美国Pharmcia公司);免疫荧光标记小鼠抗人抗体CD34-PE、CD45-FITC、CD105-FITC和CD166-FITC (美国BD PharMingen公司);党参(DS)标准对照药材(中国药品生物制品检定所)。
1.2 方法 1.2.1 DS提取液制备水煮醇沉法制备DS药液:取DS标准药材,分别加8倍及6倍体积水煮沸浓缩过滤,合并2次滤液。用95%乙醇等体积沉淀1次,取上清,加热回收乙醇至尽,配成浓度1 kg/L的药液,调pH至7.0~7.4,滤膜过滤减菌,-20 ℃保存备用〔7〕。实验时用培养液分别稀释为1.25,2.5,5.0和10.0 g/L浓度。
1.2.2 MSCs分离与扩增以1.077×103g/L细胞分离液分离MSCs,用含10%FCS的细胞培养液,培养扩增细胞,P5~P10代细胞用于实验〔8〕。
1.2.3 实验分组DMEM组(不含FCS的DMEM培养液,为不加血清对照组);DMEM+DS组;FCS组(含10%FCS的DMEM培养液,为加血清对照组);FCS+DS组。
1.2.4 MTT检测(1)测定DS浓度变化与MSCs增殖关系:取对数生长期的MSCs,以每孔2×103个细胞接种96孔板中,常规培养24 h,加入不同浓度的DS(1.25,2.5,5和10 g/L),每个浓度设6个复孔,培养3 d。每孔加入MTT溶液(5 g/L)20 μl,孵育4 h,加入二甲基亚砜(DMSO)150μl终止反应,酶标仪测定波长490 nm处的吸光度(A490)值。按下列公式计算:细胞增殖率(%)=实验组A490/正常对照组A490×100%。按线性回归分析法作图,以吸光度为纵坐标, 药物浓度为横坐标, 作剂量与效应曲线,用曲线的线性部分评价效应指数与细胞增殖关系。(2)测定DS对MSCs增殖影响:将5g/L作为实验用DS浓度,用生长在96孔板中的细胞,分别加入各组实验培养液(DMEM、DMEM+DS、FCS和FCS+DS),连续7d检测A490值。
1.2.5 形态学观察将细胞分FCS和FCS+DS组培养7d,在倒置相差显微镜下观察细胞形态改变。
1.2.6 细胞周期和凋亡检测将细胞分2组(DMEM和DMEM+DS)培养10d,收集细胞,70%冷乙醇固定,4℃过夜。以107个/L细胞重悬于磷酸盐缓冲液(PBS)中,调体积为100μl,加入DNA染色液〔核糖核酸酶(RNase)A 0.05g/L,碘化丙锭(PI)0.1g/L,Triton×100 0.1%〕500μl,室温避光20mim。流式细胞仪(FACSean,美国BD公司)测定细胞DNA含量,分析各细胞周期所占百分比,亚二倍体细胞数代表凋亡细胞数。
1.2.7 MSCs免疫表型的鉴定将细胞分为FCS和FCS+DS组,培养7d,收集细胞,1500r/min离心15min,PBS洗涤3次,分别加入荧光标记的抗体CD34-PE、CD45-FITC、CD105-FITC和CD166-FITC,4℃孵育30min,PBS洗去未标记抗体,1%多聚甲醛固定,流式细胞仪检测细胞免疫表型。
1.3 统计分析应用SPSS 10.0软件进行分析,用单因素方差分析比较组间差异,两两之比采用最小显著差(least significant difference, LSD)-t检验。
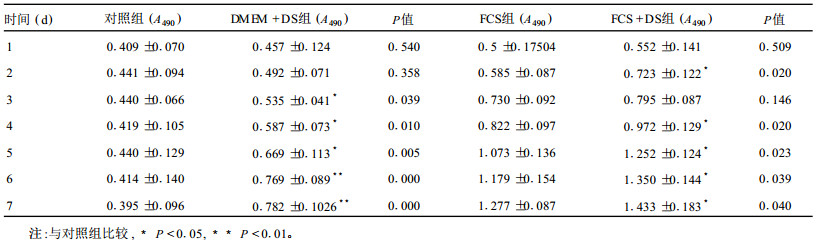
2 结果 2.1 不同浓度DS与MSCs增殖的关系(表 1)| 表 1 不同浓度DS作用MSCs的增殖效应( x±s, n=6) |
表 1可见,DS在4个不同浓度(1.25,2.5,5.0和10.0g/L)均使MTT法检测的吸光度值较对照组升高。当浓度为1.25g/L时,即出现增殖效应,与对照组比较,差异有统计学意义(P<0.05),增殖率为106.61%;当浓度≥2.5g/L时,增殖效应更为显著(P<0.01)。在此浓度范围内,未观察到DS有细胞毒性作用。为进一步研究DS对MSCs增殖影响,本研究将5g/L作为DS实验用药剂量。
2.2 DS对MSCs增殖的影响(表 2)| 表 2 不同时间DS对MSCs增殖的影响( x±s, n=6) |
表 2可见,加DS组从第3d(DMEM+DS)或第4d(FCS+DS)开始,能量代谢增强,A490明显高于对照组(DMEM、FCS),差异有统计学意义(P<0.05),表明DS有促进MSCs增殖的作用。
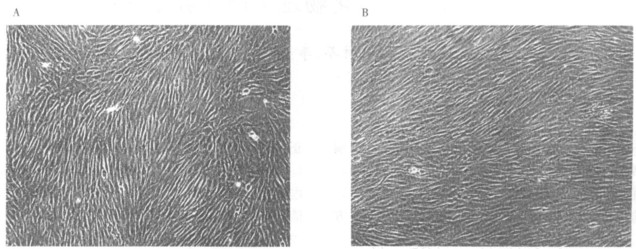
2.3 DS对MSCs形态的影响(图 1)
|
A: FCS组(正常条件培养); B: FCS +DS组(加党参培养)。 图 1 DS处理7d后与对照组形态比较(×100) |
图 1可见,倒置相差显微镜下,DS组(FCS+DS)与对照组(FCS)细胞比较,形态上无明显改变,为成纤维样细胞形态,呈长梭型,胞浆饱满,立体感强,平行排列生长或旋涡状生长。另外还观察到党参处理后的细胞数量增多,密度增加(FCS+DS>FCS)。注:A:FCS组(正常条件培养);B:FCS+DS组(加党参培养)。
2.4 DS对MSCs周期及凋亡的影响流式细胞仪分析2组培养10d的细胞,未发现有DNA倍体异常(diploid:100%)。计算细胞周期各阶段的百分含量变化结果表明,DS组(DMEM+DS)与对照组(DMEM)相比,G0+G1期〔DMEM+DS=(91.63±0.93)%,DMEM=(93.48±0.72)%,n=3,P=0.021〕细胞百分含量减少,S期〔DMEM+DS=(2.14±0.25)%,DMEM=(1.10±0.04)%,n=3,P=0.047〕和S+G2+M期〔DMEM+DS=(8.38±0.94)%,DMEM=(6.53±0.72)%,n=3,P=0.022〕细胞百分含量增多。10d后凋亡指数(凋亡细胞百分率)表明,DS组〔(1.04±0.62)%〕与对照组〔(3.45±1.33)%,n=3,P=0.005〕相比,凋亡细胞百分率明显降低,差异有统计学意义(P<0.05)。
2.5 DS对MSCs免疫表型的影响流式细胞仪分析可见,DS组(FCS+DS)与正常培养组(FCS)细胞皆表达CD105和CD166,不表达CD34和CD45。部分样本结果显示,FCS组CD105阳性细胞比率为90.16%,CD166阳性细胞比率为96.06%;FCS+DS组CD105阳性细胞比率为88.63%,CD166阳性细胞比率为96.69%。
3 讨论人骨髓MSCs易获得、可体外扩增、具有多分化潜能。骨髓中MSCs含量极少,原代获得的MSCs远远达不到要求的数量,需要体外大量培养扩增。
本研究显示,DS对MSCs无细胞毒性作用,并且可呈剂量和时间依赖性促进MSCs的增殖。DS处理后的MSCs形态无改变,提示DS不能诱导MSCs分化。细胞周期分析显示,DS未引起细胞DNA倍体异常,间期(G0+G1)细胞比例占90%以上,表明绝大部分细胞处于静止态,但保留自我更新和增殖能力,少部分处于功能态,这符合干细胞的特性〔9〕。DS引起了S期和整个增殖期(S+G2+M)细胞比例升高,同时伴随G0+G1期细胞比例降低,说明DS是通过促进细胞DNA合成,从而促进了MSCs的增殖,与以前报道相符〔10〕。细胞增殖过程中偶联着细胞凋亡,凋亡细胞指数分析表明,DS阻止了MSCs的凋亡,从而起到保护细胞的作用。DS抗MSCs凋亡的机制尚不明确。据文献报道,各种原因引起的细胞凋亡出现之前,细胞内Ca2+超载,抑制胞浆内Ca2+的升高可阻止细胞发生凋亡〔11〕。
MSCs没有单一的表面标志,它表达了间质细胞、内皮细胞和表皮细胞的表面标志。目前一般认为, CD29、CD44、CD105、CD166及SH2、SH3是MSCs的重要标志物〔9〕。流式细胞仪检测显示,DS处理的MSCs不表达造血细胞表面抗原如造血前体细胞标志抗原CD34和白细胞标志抗原CD45,而高表达粘附分子如CD166以及CD105,这表明DS处理的MSCs免疫表型未发生改变。总之,DS在促进MSCs增殖的同时,未改变MSCs的生物学特性,即对MSCs没有诱导分化的作用,使MSCs仍然保持高度的自我更新能力和分化潜能。
| [1] | Makino S, Fukuda K, Miyoshi S, et al. Cardiomyocytes can be generated from marrow stromal cells in vitro[J]. J Clin Invest, 1999, 103(5) : 697–705. DOI:10.1172/JCI5298 |
| [2] | Wang JS, Shum-Tim D, Chedrawy E, et al. The coronary delivery of marrow stromal cells for myocardial regeneration:pathophysiologic and therapeutic implications[J]. J Thorac Cardiovasc Surg, 2001, 122(4) : 699–705. DOI:10.1067/mtc.2001.116317 |
| [3] | Horwitz EM, Prockop DJ, Fitzpatrick LA, et al. Transplantability and therapeutic effects of bone marrow derived mesenchymal cells in children with osteogenesis imperfecta[J]. Nat Med, 1999, 5(3) : 309–313. DOI:10.1038/6529 |
| [4] | Schwarz EJ, Alexander GM, Prockop DJ, et al. Multipotential marrow stromal cells transduced to produce L-DOPA:engrafment in a rat model of Parkins on disease[J]. Hum Gene Therapy, 1999, 10(15) : 2539. DOI:10.1089/10430349950016870 |
| [5] | 张壮, 闫彦芳, 韦颖, 等. 党参总皂苷抗缺氧缺糖再给氧诱导大鼠皮质神经细胞凋亡的作用[J]. 中国临床康复, 2005, 9(1) : 131–133. |
| [6] | 张兆强, 韩春姬, 李莲姬, 等. 轮叶党参醇提取物对淋巴细胞增殖的影响[J]. 中国公共卫生, 2005, 21(4) : 467. |
| [7] | 秦腊梅, 肖永华, 牛福玲, 等. 三仙汤对成骨细胞增殖的影响[J]. 中国临床康复, 2002, 6(7) : 992–993. |
| [8] | 项鹏, 张丽蓉, 陈振光, 等. 成人骨髓间充质干细胞定向诱导为脂肪细胞的研究[J]. 中国病理生理杂志, 2001, 17(7) : 598–601. |
| [9] | 高向景, 姚耿东. 间充质干细胞的研究进展及其应用[J]. 浙江预防医学, 2008, 3(20) : 60–62. |
| [10] | 张子理, 陈蔚文. 党参、白术提取物配伍应用对小肠上皮细胞增殖的影响[J]. 广州中医药大学学报, 2002, 19(2) : 137–140. |
| [11] | 高唱, 吴伟康. Atk信号通路在HD02抗慢性前脑缺血大鼠神经细胞凋亡中的作用[J]. 中国临床康复, 2004, 8(1) : 56–57. |
 2009, Vol. 25
2009, Vol. 25