幽门螺杆菌(Helicobacter pylori, Hp)已被WHO宣布为Ⅰ类致癌因子〔1〕。近年来,螺杆菌感染与食管癌的关系也受到关注。德国学者Bohr等报道〔2〕,南非食管癌病人存在螺杆菌感染,国内一些学者亦进行了有关方面的研究,我国广东潮阳地区食管癌和慢性食管炎组织存在海尔曼螺杆菌感染〔3〕。生物病原体感染引起的慢性炎症一直被认为是肿瘤形成的主要因素。本课题组检测和分析食管癌组织中螺杆菌16 SrRNA基因及Hp毒力基因, 并通过体外试验观察Hp感染与炎性信号通路关键分子NF-κB抑制因子(IκB)的关联, 为探讨螺杆菌感染与食管癌的关系以及为研究人类消化道可能存在与Hp不同的种型提供相关依据。
1 对象与方法 1.1 对象随机收集同济医院和协和医院胸心外科2006年5~12月的食管癌患者手术切除标本37例,患者年龄35~80岁,平均50岁;其中男性34例,女性3例,均来自湖北地区,包括食管癌高发区钟祥县。均经活检和手术后2次病理学确诊为食管磷癌,术前均未经任何特殊治疗。同时选取健康正常食管上皮10份(同济医学院法医系提供)。
1.2 方法 1.2.1 试剂食管癌细胞株EC109(南方医科大学消化内科王继德教授馈赠);幽门螺杆菌标准株NCTC11637(CagA+, VacA+)和NCTC11639(CagA+, VacA-)(中国疾病预防控制中心幽门螺杆菌保藏中心张建中教授馈赠);32位丝氨酸磷酸化的核转录因子抑制因子(P-IκB-α(ser32))鼠单克隆抗体(SC-8404)(美国Santa Cruz公司);β-肌动蛋白(β-actin)小鼠单克隆抗体(ab6276,美国Abcam公司);肿瘤坏死因子α(TNF-α)(美国Sigma公司);改良伊格尔氏培养基(DMEM)、4-(2`-羟乙基)-1-哌嗪乙基磺酸(HEPES)、谷氨酰胺(美国Gibco公司);新生牛血清(杭州四季青公司);青霉素、链霉素(华北制药股份公司)。
1.2.2 DNA的提取及纯化参照文献[5]酚/氯仿法提取。
1.2.3 PCR扩增采用文献〔6〕方法, 针对螺杆菌属16S rRNA设计的通用引物,PCR总反应体积为40 μl,内含1.5 mmol/L MgCl,50 mmol/L KCl,10 mmol/L Tris-HCl,2种引物各20 pmol,2U Taq酶,0.2 mmol/L的dNTP,模板2 μl,紫外灯检测仪上观察结果,出现767bp DNA扩增带为阳性,阳性者再扩增幽门螺杆菌特异性毒力基因(cagA, vacA, babA2),引物参照文献〔7, 8〕,均由上海英骏公司合成。PCR反应体积为25 μl,含有1.5 mmol/L MgCl,50 mmol/L KCl,10 mmol/L Tris-HCl,2种引物各0.5 mmol/L,1.25 U Taq酶,0.2 mmol/L的dNTP,模板1 μl。PCR在不同时间和地点重复进行,两者结果一致者为阳性,不一致者重新提取模板扩增,阳性对照为本实验室保存的Hp DNA。16 SrRNA引物为:F-5′-ggctatgacgggtatccggc-3′R-5′-gccgtgcagcacctgttttc-3′PCR反应参数:90 ℃ 5 min,94 ℃ 45 s,59 ℃ 45 s,72℃ 60 s,35循环,72 ℃ 10 min。cagA引物为:F-5′-atggaaatacaacaaacacac-3 R-5′-ctgcttgaatgcgccaaac-3′PCR反应参数:90 ℃ 5 min,94 ℃ 20 s,55 ℃ 45 s,72 ℃ 45 s,35循环,72 ℃ 10 min。babA2引物为:F-5′-atccaaaaaggagaaaaaagtatgaaa-3′R-5′-tgttagtgatttcggtgtaggaca-3PCR反应参数:90 ℃ 5 min,94 ℃ 60s,55~62 ℃ 45 s,72 ℃ 60 s,35循环,72 ℃ 10 min。VacA引物为:F-5-ggcaatggtggtggtcctggagctagg-3′R-ggaaatctttaatctcagttcgg-3′PCR反应参数:90 ℃ 5 min,94 ℃ 20 s,55 ℃ 45 s,72 ℃ 30 s,35循环,72 ℃ 10 min。
1.2.4 分子克隆、测序及同源性比较参照文献〔9〕方法。
1.2.5 细胞与细菌培养(1)食管鳞癌细胞株(EC109)接种在含10%灭活小牛血清、100 μg/ml青霉素和100 μg/ml链霉素的DMEM培养基中,pH 7.2~7.4,置于37 ℃ 5% CO2和95%湿度的培养箱中完全培养,细胞2 d换液,85%汇片时传代。(2)幽门螺杆菌标准株的培养和稀释到感染复数(MOI)为100参照BRUNO NEU等方法〔9〕。
1.2.6 细菌细胞共培养细胞在6孔板传代生长1 d至汇片60%时,用D-HANKS液漂洗2次,换上不含血清和抗生素的培养基继续培养16h,加上不含胎牛血清的无抗生素DMEM培养液制成细菌悬液,使感染复数(MOI)=100, 细菌细胞混合继续放于细胞培养箱中继续分别培养0.5,1,2,3 h。作为阳性对照,TNF用预冷的磷酸盐缓冲液(PBS)稀释,加到细胞培养的6孔板中,使其终浓度为10 ng/ml,分别培养10,20,30 min。
1.2.7 蛋白免疫印迹(Western blot)检测封闭前步骤参照Yoshoihiro Hirata等实验步骤〔10〕, 封闭结束后加入P-IκB-α鼠抗人单克隆抗体(工作浓度1:500)37 ℃孵育1.5 h,含1‰吐温20的PBS缓冲液漂洗3×5 min后,再加辣根过氧化物酶(HRP)标记的羊抗鼠二抗(工作浓度为1:2000)37 ℃孵育1.5 h,PBS吐温(PBST)漂洗3×5 min。蛋白印迹化学发光法(ECL)显影,以β-actin (工作浓度为1:6 000)为内参照,加入抗体反应,显色结果凝胶成像分析系统(美国BioRad公司)扫描分析,测量条带灰度值。目的条带与β-actin条带灰度值比值即为此目的蛋白的相对表达量。结果为3次实验结果平均值。
2 结果 2.1 螺杆菌检测结果37例手术切除标本中,有12例扩增出767 bp的目的片断, 阳性率为31.6%,10份正常组织中均无阳性表达(P<0.05),两者差异有统计学意义。
2.2 PCR扩增螺杆菌16Sr RNA基因及相关毒力基因37例手术切除标本中,有12例扩增出767 bp的目的片断(图 1)。12例阳性标本中,cagA阳性4例,babA2阳性8例,vacA阳性3例(图 2~4)。
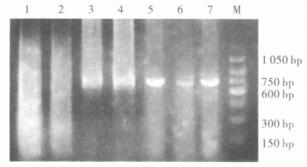
|
基因片断767 bp;1:正常食管标本;2:阴性标本;3:阳性对照;4~7:阳性标本;M:150 bp的marker (从150~1 050 bp)。 图 1 螺杆菌属16S rRNA基因 |
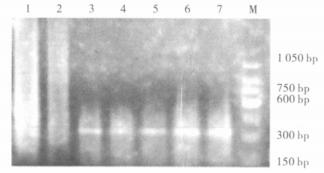
|
基因片断325 bp;1:正常食管标本;2:阴性标本;3:阳性对照;4~7:阳性标本;M.150bp的marker (从150~1 050 bp)。 图 2 Hp特异性毒力基因cagA |
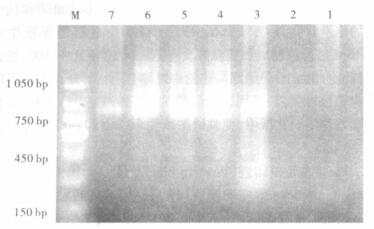
|
基因片段850 bp, 1:正常食管标本;2:阴性标本;3:阳性对照;4~7:阳性标本;M:150bp的marker (从150~1 050 bp)。 图 3 Hp特异性毒力基因babA2 |
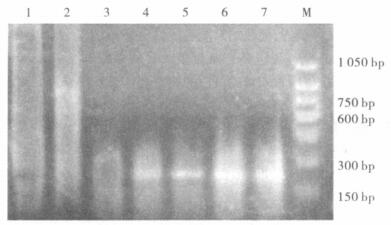
|
基因片段259 bp;1:正常食管标本;2:阴性标本;3:阳性对照;4~7:阳性标本;M:150bp的marker (从150~1 050 bp)。 图 4 Hp特异性毒力基因vacA |
2.3 基因同源性比对
随机选取9个阳性标本的PCR产物与螺杆菌进行序列比对,并进行同源性分析。结果发现,均与H pylori 16 SrRNA基因具有99%~100%的同源性。在NCBI中用blast程序对测序的9例标本进行比对,有7例与以往序列不同,分别被GenBank收录,登陆号:EF217408-EF217414。
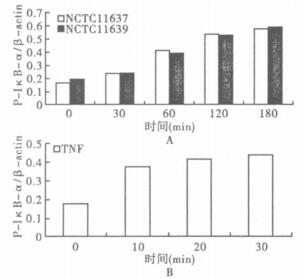
2.4 蛋白免疫印迹(Western blot)分析幽门螺杆菌NCTC11637,NCTC11639与EC109分别培养不同时间后,P-IκB(ser32)-α与内参β-actin的比值升高,其中30~120 min之间变化最快,后来逐渐减慢,且2组细菌间没有区别(图 5A)。与阳性对照TNF-α组有相同的变化趋势(图 5B)。
|
图 5 P-IκB(ser32)-α与β-actin的比值的蛋白免疫印迹分析 |
3 讨论
本文结果显示,湖北地区食管癌标本分离的螺杆菌,16SrRNA基因阳性率为31.6%。其中9例标本的基因同源性分析表明,与Hp有99%~100%的同源性,提示该细菌很可能为Hp。
babA2为黏附素基因,阳性表达率在中国报道一般为60%左右。cagA编码致病岛,在大多毒力株中都有表达。vacA编码一种空泡毒素,应该在所有的Hp中都为阳性〔12〕。但本研究Hp特异性毒力基因(cagA, babA2, vacA)检测结果显示,12例阳性标本中,上述3个毒力基因分别只有4,8和3例阳性, 提示该菌与Hp非常相近,但基因vacA携带与Hp明显不同,同时16 S rDNA与GenBank公布的Hp也有差异,提示食管癌组织感染的螺杆菌有可能与寄生于胃的Hp有一定差别,有可能该菌在种系发生上存在Hp的亚种或型,有待于进一步研究。
IκB-α是IκB家族中的主要抑制因子之一,在炎性信号传导未启动时与NF-κB结合为复合体,阻止NF-κB进入细胞核。但在炎性信号刺激时,IκB-α被激酶磷酸化为P-IκB-α并与NF-κB解离。本研究将Hp标准株NCTC11637和NCTC11639分别与食管磷癌细胞株EC109共培养后,P-IκB-α含量明显升高。与阳性对照TNF-α有相同的变化趋势,2组表达量差异无统计学意义。TNF-α既是在上游信号通路作用下细胞表达的炎性细胞因子,也能够启动炎症信号激酶活化和炎症分子表达的主要前炎细胞因子,说明螺杆菌感染对P-IκB-α的影响。同时此结果与先前的研究结果,即Hp 16S rDNA阳性的食管癌NF-κB P65的变化相一致〔11〕。
| [1] | Luca A D, Iaquinto G.Helicobacter pylori and gastric diseases:a dangerous assiciation[J].Cancer Lett, 2004, 21, 3(1):1-10. |
| [2] | Bohr UR, Primus A, Zagoura A, et al. A group-specific PCR assay for the detection of Helicobacter aceae in human gut[J]. Helicobacter, 2002, 7 : 378–383. DOI:10.1046/j.1523-5378.2002.00113.x |
| [3] | 周志韶, 马澄城, 廖赞豪, 等. 广东潮阳地区海尔曼螺杆菌感染与食管疾病的相关性研究[J]. 世界华人消化杂志, 2004, 12(7) : 1593–1595. |
| [4] | Coussens LM, Werb Z. Inflammation and cancer[J]. Nature, 2002, 420(6917) : 860–867. DOI:10.1038/nature01322 |
| [5] | 周密, 廖永德, 叶嗣颖, 等. 人食管癌组织存在螺杆菌16S rRNA基因[J]. 华中科技大学学报:医学版, 2006, 35(5) : 580–583. |
| [6] | 杨学文, 王礼文, 陈云峰, 等. 幽门螺杆菌VacA基因分型和CagA基因检测[J]. 中国卫生检验杂志, 2000, 10(4) : 391–393. |
| [7] | Lai CH, Kuo CH, Chen YC, et al. High prevalence of cagA and babA2-positive helicobacter pylori clinical isolates in Taiwan[J]. Journal of Clinical Microbiology, 2002 : 3860–3862. |
| [8] | Neu B, Randlkofer P, Neuhofer M, et al. Helicobacter pylori induces apoptosis of rat gastric parietal cells[J]. Arn J Physiol Gastrointest Liver Physiol, 2002, 283 : 309–318. DOI:10.1152/ajpgi.00546.2001 |
| [9] | Hirata Y, Maeda S, Ohmae T, et al. Helicobacter pylori induces ikappaB kinase alpha nuclear translocation and chemokine production in gastric epithelial cells[J]. Infection and Immunity, 2006, 74(3) : 1452–1461. DOI:10.1128/IAI.74.3.1452-1461.2006 |
| [10] | 张丽, 叶嗣颖, UlrichBohr, 等. 螺杆菌感染与NF-κB p65蛋白表达相关性在人食管癌发生中的意义[J]. 中华微生物与免疫学杂志, 2007, 27(3) : 234–239. |
 2009, Vol. 25
2009, Vol. 25

 , 张正茂, 田拥军, 张丽, 周密, 李春艳
, 张正茂, 田拥军, 张丽, 周密, 李春艳