2. 中国医科大学公共卫生学院;
3. 辽宁省疾病预防控制中心
婴儿配方奶粉常因阪崎肠杆菌(Enterobacter sakazakii)污染而成为婴儿感染发病的主要原因〔1, 2〕。为快速、高效对奶粉中阪崎肠杆菌进行检测和监控, 本实验针对阪崎肠杆菌外膜蛋白A(ompA)基因〔3〕设计引物, 建立PCR检测方法, 并对人工污染细菌的奶粉进行检测, 为奶粉中阪崎肠杆菌检测提供新的手段。现将结果报告如下。
1 材料与方法 1.1 材料 1.1.1 菌株阪崎肠杆菌(2株, 标准菌株、野生菌株各1株)、大肠埃希菌8株、沙门菌4株(辽宁省疾病预防控制中心)。
1.1.2 主要仪器与试剂(1)仪器:低温高速离心机、PCR基因扩增仪、电泳仪、凝胶成像系统、微量进样器、培养箱。(2)试剂: Taq DNA聚合酶、dNTPs、琼脂糖、PCR分子量标记(大连宝生物公司); GeneFinder (厦门百威信生物科技有限公司); 万古霉素改良月桂基硫酸盐胰蛋白胨肉汤(MLST)培养基、脑心浸液(BHI)、营养肉汤(北京陆桥技术有限责任公司); 其他试剂均为分析纯。
1.1.3 引物合成根据文献〔3〕, 利用阪崎肠杆菌ompA基因设计引物, 委托大连宝生物公司合成。其序列为:上游(F) : 5′-GGATTTAACCGTGAACTTTTCC-3′, 下游(R) : 5′-CGCCAGCGATGTTAGAAGA-3′, 该引物产生469 bp的扩增产物。
1.1.4 奶粉购自超市。
1.2 方法(1)菌种准备:将实验所用各菌株分别接种至营养肉汤中, 37 ℃过夜培养。(2)模板DNA的制备:采用酚、氯仿法, 参照文献〔4〕进行。(3)扩增体系和程序:反应体系(25 μ1) : 10 × Ex Taq buffer (+Mg2+)5 μl, 正、反向引物各1 μl (1 μmol/L), dNTPs 4 μl (2.5 mol/L), Taq酶0.25 μl (5 U/μl), 模板为3 μl (阴性对照为等量双蒸水), 加双蒸水补足50 μl。扩增反应程序: 94 ℃预变性, 3 min; 94 ℃变性, 30 s; 60 ℃退火, 45 s; 72 ℃延伸, 45 s, 35个循环; 72 ℃, 5 min。用1 ×TAE电泳缓冲液配制2%琼脂糖凝胶, 上样量为5 μl, 电泳电压为100 V, 40 min。用凝胶成像系统观察电泳结果并进行分析。(4)特异性测定:对经传统方法验证的2株阪崎肠杆菌进行PCR特异性检测, 并利用经传统方法鉴定的12株非阪崎肠杆菌株(8株大肠埃希菌、4株沙门菌)进行PCR特异性验证。(5)灵敏度测定:配制108 CFU/ml浓度菌液, 然后无菌操作按10倍递增稀释, 使菌液浓度为108~100 CFU/ml, 并进行菌落计数, 取各浓度菌液1 ml, 提取DNA〔4〕, 进行PCR检测后, 计算检出限。(6)模拟样品的检测:将100 g用传统方法鉴定阪崎肠杆菌为阴性的奶粉无菌操作分别加到900 mlMLST培养基中形成均汁液, 将阪崎肠杆菌单独或者和大肠埃希菌、沙门菌一起分别按照3~6 CFU/100 g的浓度接种到均汁液中, 取等体积的生理盐水加入另一份均汁液中做阴性对照。充分振荡, 44 ℃培养24 h, 取1 ml增菌液加到9 ml的脑心浸液(BHI)中, 在37 ℃, 恒温培养4 h后, 取1 ml的BHI增菌液, 提取其基因组DNA及PCR扩增〔4〕。
2 结果 2.1 方法的特异性(图 1)
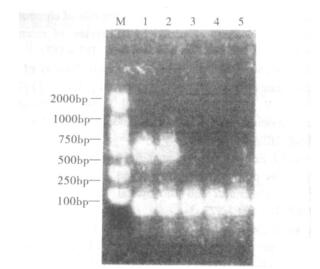
|
注: M: DNA marker; 1:阪崎肠杆菌标准菌株; 2:阪崎肠杆菌野生菌株; 3:大肠埃希菌; 4:沙门菌; 5:阴性对照。 图 1 阪崎肠杆菌PCR方法特异性检测结果 |
图 1可见, 经传统方法鉴定的2株阪崎肠杆菌全部扩增出469 bp的产物, 而大肠埃希菌、沙门菌以及阴性对照均未扩增出此产物。
2.2 方法的灵敏度(图 2)
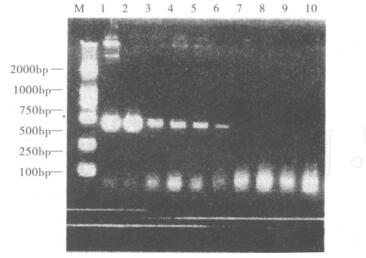
|
注: M: DNA marker; 1~9:菌液浓度依次为108~100 CFU/ml; 10:阴性对照。 图 2 阪崎肠杆菌PCR方法灵敏度检测结果 |
图 2可见, 菌液浓度为103 CFU/ml时仍可见扩增条带, 表明本方法最小检出量为103 CFU/ml。
2.3 模拟样品的检测(图 3)
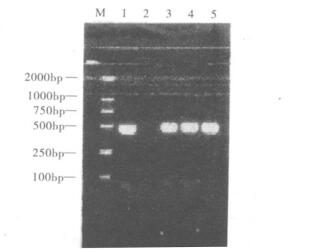
|
注: M: DNA marker; 1:阳性对照; 2:阴性对照; 3:单独污染阪崎肠杆菌; 4:混合污染阪崎肠杆菌和大肠埃希菌; 5;混合污染阪崎肠杆菌和沙门菌。 图 3 模拟样品的PCR检测结果 |
图 3可见, 无论是单独污染阪崎肠杆菌还是和大肠埃希菌或沙门菌一起污染的奶粉, 本方法均出现阪崎肠杆菌的特异性扩增产物, 阴性对照无此扩增产物。
3 讨论婴儿配方奶粉中阪崎肠杆菌污染, 可危害婴儿身体健康。国内传统检验是参照美国食品药品管理署(FDA)推荐的方法〔5〕。其检出时间长达6~7 d, 实验步骤繁琐, 可操作性差, 已不能满足食品安全监测的需要。分子生物学尤其是PCR技术, 为阪崎肠杆菌的快速检测提供了基础依据。
阪崎肠杆菌的ompA基因具有高度的保守性, Nair〔3〕等通过鉴定和分子克隆ompA基因, 建立了针对该基因的PCR检测阪崎肠杆菌的方法。本次检测结果表明, 利用针对ompA基因设计的引物经PCR扩增后的产物对阪崎肠杆菌具有较好的特异性; 另外利用本引物检测阪崎肠杆菌的灵敏度较高。结果表明, 本实验建立的方法对纯菌的检测灵敏度可达103 CFU/ml。
食品中如含菌量少, 达不到检测的灵敏度; 此外食品中含有某些能够干扰检测的物质, 可造成假阴性结果。因此, 本实验进行了模拟样品的检测。对人工污染奶粉进行了增菌培养, 并且对培养物进行PCR检测。为了使模拟样品更接近于实际样品, 将阪崎肠杆菌单独或者和大肠埃希菌或沙门菌分别按照3~6 CFU/100 g的浓度一起接种到均汁液中。检测结果表明, 奶粉经28 h增菌、提取DNA, 再经PCR扩增, 无论是将阪崎肠杆菌单独接种, 还是与大肠埃希菌或沙门菌一起接种, 于均汁液中均可检出特异性扩增产物。表明检测结果未受其他细菌干扰。
与传统方法比较, 本检测方法灵敏度高, 特异性好, 检测快速(整个检测可在36 h内完成)、简单, 具有实际应用价值。
| [1] | van Aker J, de Smet F, Muyldermans G, et al. Outbreak of necrotizing enterocolitis associaed with Enterobacter sakazakii in powdered milk[J]. J Clin Microbiol, 2001, 39(1) : 293–297. DOI:10.1128/JCM.39.1.293-297.2001 |
| [2] | 赵贵明, 袁飞, 陈颖, 等. 奶粉中阪崎肠杆菌分离鉴别方法研究[J]. 中国公共卫生, 2006, 22(2) : 207–208. |
| [3] | Mohan Nair MK, Venkitanarayanan NK. Cloning and sequencing of the ompA gene of Enterobacter sakazakii and development of an ompA-Targeted PCR for rapid deteetion of Enterobacter sakazakii in infant formula[J]. Applied Environmental Microbiology, 2006, 72(4) : 2539–2546. DOI:10.1128/AEM.72.4.2539-2546.2006 |
| [4] | 夏涵, 府伟灵, 陈鸣, 等. 快速提取细菌DNA方法的研究[J]. 现代预防医学, 2005, 32(5) : 571–573. |
| [5] | 张爱霞, 生庆海, 张涛. 食品中阪崎肠杆菌分析及其检测[J]. 中国乳品工业, 2005, 33(10) : 42–44. |
 2009, Vol. 25
2009, Vol. 25

 , 胡英3, 文涛3, 张志瑜2, 米超2
, 胡英3, 文涛3, 张志瑜2, 米超2