2. 天津医学大学免疫教研室;
3. 天津医学大学病理教研室;
4. 天津医科大学毒理教研室
骨骼肌是全身利用葡萄糖的主要组织之一, 也是高血糖损害的主要靶位。肌无力、肌萎缩、肌肉酸痛是糖尿病的常见症状。糖尿病肌病的发病机制至今仍不清楚。生理条件下, 体内不断地产生活性氧代谢物并被细胞内外的抗氧化系统清除。如果自由基在体内产生过多或清除减少, 就会在体内积聚。有研究显示, 糖尿病时机体存在明显的氧化应激〔1〕。本实验观察了链脲佐菌素诱导的糖尿病大鼠骨骼肌组织的脂质过氧化物丙二醛(malondialdehyde, MDA)及超氧化物歧化酶(superoxide dismutase, SOD)的动态改变, 为糖尿病肌病的防治提供理论依据。
1 材料与方法 1.1 材料(1)动物: Sprague-Dawley (SD)雄性大鼠(北京维通利华实验动物技术有限公司)。许可证号: SCXX (京) 2002-2003;体重260~300 g。(2)主要试剂:链脲佐菌素(STZ, 美国Sigma公司)临用前溶于0.1 mol/L柠檬酸盐缓冲液, pH 4.4;血糖试剂盒(保定长城临床试剂有限公司); 蛋白质定量试剂盒(北京百泰克生物技术有限公司); MDA和SOD测定试剂盒(南京建成生物工程研究所); 匀浆介质: 0.01 mol/L Tris, 0.0001 mol/L乙二胺四乙酸二钠盐, 0.01 mol/L蔗糖, 0.8%NaCl, pH 7.4。氨基甲酸乙酯、甲醛为分析纯化学试剂。
1.2 糖尿病动物模型的建立及分组48只SD大鼠随机分成对照组(n=18)和糖尿病组(n=30), 每组又分为1, 3和6个月3个亚组。糖尿病组按45 mg/kg一次性尾静脉注射STZ诱发糖尿病, 对照组只给予等量的缓冲液。1周后测血糖, 血糖> 16.7 mmol/L, 饮水及尿量明显增多者为糖尿病大鼠模型。
1.3 病理观察分别在测血糖后的1, 3, 6个月, 各组大鼠用氨基甲酸乙酯深度麻醉后, 取出一侧下肢股四头肌, 放入液氮中, 然后转移至-70℃冻存, 用于测定MDA水平和总SOD活性。取出另一侧下肢股四头肌, 放于15%中性甲醛中固定, 用于观察糖尿病不同时期股四头肌的病理改变。
1.4 组织形态学观察及指标测定(1)不同时期各组大鼠股四头肌经甲醛固定后, 常规石蜡包埋, 苏木素-伊红(HE)染色, 光镜下观察糖尿病不同时期股四头肌的病理改变。(2)肌肉组织匀浆的制备:用预冷的生理盐水洗去股四头肌表面的血迹, 然后用滤纸拭干, 称取0.1 g左右股四头肌放入1.5 ml的离心管内, 加入0.9 ml左右匀浆介质, 组织剪碎后, 离心管放在冰盒内, 用超声粉碎仪制备10%肌肉组织匀浆, 匀浆液3 000 r/min离心10 min, 留取上清, 测定MDA水平和总SOD活性。(3)血糖测定:造模1周和取材前内眦静脉取血测血糖。(4)蛋白质浓度的测定:采用Bradford法蛋白定量试剂盒测定匀浆上清中蛋白质的浓度。(5) MDA和SOD活性测定:分别采用MDA和SOD测定试剂盒。
1.5 统计分析采用SPSS 11.5统计软件进行分析; 各组数据的比较采用独立样本t检验。
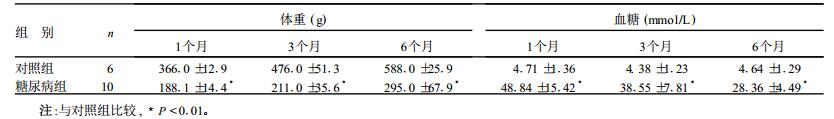
2 结果 2.1 2组大鼠体重和血糖比较(表 1)| 表 1 2组大鼠不同时期体重及血糖变化( x±s) |
糖尿病造模后大鼠出现明显的多饮、多食、多尿症状, 体重明显下降, 血糖明显升高。
2.2 糖尿病大鼠不同时期股四头肌的病理改变(图 1)

|
注: A:正常对照大鼠的股四头肌; B:糖尿病3个月大鼠的股四头肌(肌纤维断裂, 箭头所指); C:糖尿病6个月大鼠的股四头肌(肌纤维空泡样变性, 溶解坏死, 箭头所指)。 图 1 正常对照及糖尿病大鼠的股四头肌组织形态学观察(HE, × 100) |
糖尿病大鼠3个月时股四头肌出现病理改变, 随着病程的延长, 病理改变越严重。
2.3 大鼠肌组织中MDA水平和总SOD活性(表 2)| 表 2 2组大鼠不同时期肌组织中MDA水平及总SOD活性( x±s) |
糖尿病大鼠1个月时股四头肌组织中的MDA水平显著增高, 在6个月的观察期内一直处于较高水平。糖尿病大鼠1个月时股四头肌组织总SOD活性明显增高, 糖尿病大鼠3个月时SOD活性比1个月时明显降低, 但与对照组比较, 差异无统计学意义; 糖尿病大鼠6个月时SOD活性与对照组相比明显降低。
3 讨论糖尿病近端肌萎缩症是经典的糖尿病肌病类型, 在糖尿病患者中其患病率约为0.8%〔2〕。Gumieniczak等对四氧嘧啶诱导的糖尿病家兔骨骼肌组织的抗氧化状态进行了研究。结果表明, 糖尿病3周时MDA水平明显增加, 6周后下降至对照水平, SOD活性明显降低〔3〕。另一项研究亦表明, STZ诱导的糖尿病大鼠背肌组织中脂质过氧化物水平明显增高〔4〕。本次研究结果表明, 糖尿病大鼠1个月时MDA水平显著升高, 3个月时比1个月时明显降低, 但仍高于正常对照水平, 6个月时又明显增高。在糖尿病大鼠1个月时总SOD活性明显升高, 3个月时降至正常对照水平, 6个月时明显降低。糖尿病大鼠1个月时总SOD活性增加可能是由于自由基产生过多, 机体代偿而诱导造成的, 6个月时总SOD活性显著降低, 可能是由于自由基直接的抑制效应或者是由于酶的自身糖化〔5〕。形态学观察表明, 在糖尿病大鼠3个月时股四头肌出现病理改变, 随着病程的延长, 病理改变越严重。本研究结果表明, 在糖尿病早期(股四头肌未出现病理改变时)就已存在明显的氧化应激, 并且在肌病发展中脂质过氧化物产生持续增多, 同时抗氧化能力降低。有研究表明, 在STZ诱导的糖尿病大鼠, 氧化应激使肌性调节因子表达下降, 肌肉增强因子1(MEF-1) DNA结合活性降低, 肌肉肌酸激酶的合成以及肌浆球蛋白的重链和轻链受损。结果提示, 氧化应激启动了使肌肉受损以及肌肉修复受阻的级联放大反应〔6〕。此外, 自由基可引起多处膜系统降解, 大量膜系统的破坏会引起膜上葡萄糖转运体4的减少, 引起葡萄糖利用障碍, 导致骨骼肌无力, 加重骨骼肌胰岛素抵抗〔7〕。
| [1] | Feldman EL. Oxidative stress and diabetic neuropathy:a new understanding of an old problem[J]. J Clinical Investigation, 2003, 111 : 431–433. DOI:10.1172/JCI200317863 |
| [2] | 蒙碧辉, 舒昌达. 糖尿病骨骼肌病变[J]. 国外医学内分泌分册, 2002, 22 : 336–338. |
| [3] | Gumieniczek A, Hopkala H, Wojtowicz Z, et al. Differences in antioxidant status in skeletal muscletissue in experimental diabetes[J]. Clinica Chim ica Acta, 2001, 314 : 39–45. DOI:10.1016/S0009-8981(01)00680-5 |
| [4] | De Angelis KL, Cestari IA, Barp J, et al. Oxidative stress in the latissimus dorsimuscle of diabetic rats[J]. Braz J Med Biol Res, 2000, 33 : 1363–1368. DOI:10.1590/S0100-879X2000001100016 |
| [5] | Kakkar R, Mantha SV, Radhi J, et al. Antioxidant defense system in diabetic kidney:A time course study[J]. Life Sciences, 1997, 60 : 667. DOI:10.1016/S0024-3205(96)00702-3 |
| [6] | Aragno M, Mastrocola R, Catalano MG, et al. Oxidative stress impairs skeletal muscle repair in diabetic rats[J]. Diabetes, 2004, 53 : 1082–1088. DOI:10.2337/diabetes.53.4.1082 |
| [7] | 马春明. 糖尿病骨骼肌病变发病机制[J]. 辽宁实用糖尿病杂志, 2004, 12 : 51–53. |
 2009, Vol. 25
2009, Vol. 25