2. 吉林大学公共卫生学院卫生毒理学教研室;
3. 吉林大学公共卫生学院食品卫生与营养教研室
糖尿病是严重威胁人类健康的慢性病之一。在糖尿病发生、发展过程中, 自由基发挥了重要作用。高血糖导致的自由基大量产生和抗氧化能力下降是糖尿病并发症发生的主要机制之一。中药在预防和缓解糖尿病并发症中的应用报道较少。本研究旨在从抗氧化角度探讨黄芪对高糖环境下人脐静脉内皮细胞ECV 304的保护作用, 为黄芪在糖尿病并发症预应用防中提供实验依据。
1 材料与方法 1.1 实验材料 1.1.1 主要仪器及试剂JM -FE3AX电子自旋共振(ESR)波谱仪(日本三洋公司); 5 -恶唑烷氮氧自由基硬脂酸(5 -SA, 美国Sigma公司); 伊斯考夫改良的杜尔贝科培养基(IM-DM)粉末(美国Invitrogen公司, 批号: 1302018);黄芪注射液(RA, 黑龙江省珍宝岛制药有限公司, 批号: 20070403);标准胎牛血清(天津市灏洋生物制品科技有限责任公司, 批号: WQTC0701);葡萄糖(分析纯, 国药集团化学试剂北京有限公司); 甘露醇注射液(四平巨能药业有限公司, 批号: 0711110)。
1.1.2 细胞ECV304细胞(吉林大学白求恩医学院病理生物学教育部重点实验室)。
1.2 实验方法 1.2.1 细胞分组及处理细胞被随机分为4组:正常组、高糖组、RA组和甘露醇高渗对照组(简称甘露醇组), 每组3瓶细胞。当各瓶细胞达到约75%融合时, 细胞处理参照文献〔1〕方法。高糖组中加入葡萄糖。使葡萄糖终浓度达35 mmol/L; RA组中分别加入葡萄糖和RA, 使葡萄糖的终浓度达到35 mmol/L, RA终浓度达到500μg/ml; 甘露醇组中加入甘露醇使其终浓度达到25 mmol/L; 继续培养24 h后, 收集细胞。
1.2.2 抗氧化能力测定收集上述正常组、高糖组、RA组、甘露醇组的细胞于离心管中, 1 000 r/min离心5 min, 弃上清, 加入1 ml预冷的生理盐水, 冰浴5 min, 超声裂解细胞(强度以不产生泡沫为准), 12 000 r/min离心10 min, 上清液移至1.5 ml微量离心管中。按试剂盒说明书的操作方法测定上清中超氧化物歧化酶(SOD)活力、抗超氧阴离子自由基能力、抑制羟基自由基能力、丙二醛(MDA)含量和总蛋白含量(考马斯亮蓝法)。
1.2.3 细胞膜流动性的测定按照实验方法1.2.1中的方法同步细胞生长并施加处理因素。细胞膜流动性的测定方法参照文献〔2〕。
1.3 统计分析应用SPSS 12.0统计软件进行方差分析。
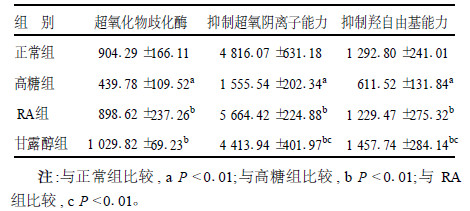
2 结果 2.1 黄芪注射液对细胞产生自则基的影响(表 1)| 表 1 RA对高糖环境下ECV 304细胞SOD活性和自由基水平的影响(n=3, x±s) |
高糖组细胞与正常组细胞比较, SOD活性显著降低, 抑制超氧阴离子和羟自由基的能力均显著下降(P < 0.01)。RA组细胞的SOD活性显著高于高糖组, 抑制超氧阴离子和羟自由基的的能力均显著高于高糖组细胞(P < 0.01)。甘露醇组细胞抑制超氧阴离子的能力显著低于RA组细胞(P < 0.01)。RA组细胞的SOD活性与正常组细胞比较, 差异无统计学意义。
2.2 黄芪注射液对细胞产生MDA水平的影响高糖组细胞产生MDA水平明显升高, 显著高于正常组细胞、RA组细胞和甘露醇组细胞(P < 0.01)。RA组细胞产生MDA水平显著低于甘露醇组(P < 0.01); RA组细胞产生MDA水平与正常组细胞比较, 差异无统计学意义。
2.3 黄芪注射液对细胞膜流动性的影响高糖组细胞膜流动性显著下降, 显著低于正常组、RA组和甘露醇组细胞(P < 0.01)。RA组细胞膜流动高于甘露醇组, 但差异无统计学意义。RA组细胞膜流动性与正常组细胞比较, 差异也无统计学意义。
3 讨论自由基能够攻击细胞膜中的不饱和脂肪酸, 使细胞膜的流动性受到影响〔3-5〕。本文应用黄芪注射液在高糖环境下与ECV 304细胞共同孵育24 h。由于黄芪注射液的抗氧化作用, 能够对高糖环境下的细胞提供保护作用, 使与其共同孵育的细胞免受自由基的攻击。因此, 黄芪保护组细胞的细胞膜流动性显著高于高糖组细胞(P < 0.05)。黄芪具有抗氧化作用, 清除自由基, 保护了细胞膜的结构和组成不受自由基的影响, 从而保护了细胞膜的流动性。
本文结果提示, 黄芪的抗氧化及对细胞膜流动性的保护作用, 对糖尿病病程中的胰岛素抵抗具有明显的缓解作用。
| [1] | Gao W, Ferguson G, Connel P, et al. High glucose concentrations alter hpoxia-induced control of vascular smooth muscle cell growth via a HIF-1α-dependent pathway[J]. Mol Cell Cardiol, 2007, 42 : 609–619. DOI:10.1016/j.yjmcc.2006.12.006 |
| [2] | 张清俊, 丛建波, 王长振, 等. 低功率微波辐射对抗氧化物酶活性基细胞膜流动性的影响[J]. 中华物理医学与康复杂志, 2007, 29(2) : 100–104. |
| [3] | Hong JH, Kia MJ, Park MR, et al. Effects of vitamin Eonoxidative stress and membrane fluidity in brain of streptozotocin-induced diabetic rats[J]. Clinica Chimica Acta, 2004, 340 : 107–115. DOI:10.1016/j.cccn.2003.10.003 |
| [4] | 尹学哲, 全吉淑, 徐俊萍, 等. 绿茶对糖尿病大鼠抗氧化活性影响[J]. 中国公共卫生, 2007, 23(12) : 1496–1497. |
| [5] | 贾文波, 许继取, 宋方方, 等. 2型糖尿病患者胰岛素抵抗和氧化应激反应[J]. 中国公共卫生, 2006, 22(7) : 769–771. |
 2009, Vol. 25
2009, Vol. 25