近年来,随着广谱抗生素、糖皮质激素、免疫抑制剂等的广泛应用,白念珠菌等真菌引起的机会性感染日益增加,已成为一个重要的公共卫生问题。由于现有的抗真菌药物较少且还有较强的毒副作用,耐药菌株的不断出现,加之生物膜相关感染(包括生物材料相关感染和慢性感染)的发生,使得寻找新的抗真菌药物成为微生物学领域的一个研究热点。已有学者开始关注中药对细菌生物膜的作用[1]。笔者近期研究也发现,某些中药具有抗白念珠菌生物膜的功能[2]。本试验拟在前期研究的基础上,进一步探讨中药有效成分苦参碱的抗生物膜功能,旨在为中药治疗由白念珠菌生物膜引起的难治性、复发性真菌感染提供指导依据。
1 材料与方法 1.1 材料(1) 菌株:白念珠菌标准株ATCC10231(安徽省合肥市疾病预防控制中心)。(2) 药物:苦参碱标准品(中国药品生物制品检定所,批号:11805);两性霉素B标准品(美国Amresco公司)。(3) 培养基:RPMI-1640培养基(美国Gibco公司);酵母膏蛋白胨葡萄糖(YPG)培养基、沙氏培养基依据文献[3]配制。(4) 主要试剂与仪器:甲基四氮盐(XTT,加拿大BBI公司):维生素K3(美国Alexis公司);曲通X-100(Triton X-100,美国Amresco公司);丙酮(蚌埠化学试剂厂),均为分析纯。磷酸盐缓冲液(PBS,pH=7.2),本室配置。318-酶标仪(上海三科仪器有限公司);96孔微量培养板(美国Corning公司);倒置显微镜(日本Olympus公司)。
1.2 方法(1) 白忿珠菌生物膜的制备:参照文献[3, 4]将100 μl的1×106个菌细胞/ml接种于96孔微量培养板中,37℃培养24 h后,倒置显微镜下初步鉴定白念珠菌生物膜的形成。(2) 苦参碱抑制白念珠菌生物膜的浓度(SMIC)测定:生物膜形成后,弃去培养基及悬浮菌,用PBS洗3次,将苦参碱按2倍稀释加到各孔中,继续培养48 h。参照文献[3, 4]用XTT减低法检测抑制生物膜50%(SMIC50) 及80%(SMIC80) 的浓度。另设对照孔(只加菌液与XTT溶液,不含苦参碱)。实验重复3次,每个浓度均设8个复孔,取平均值。(3) 苦参碱抗白念珠菌黏附作用的测定:参照文献[5, 6]将白念珠菌接种于96孔板中,分别培养0,1,2,4 h。加入按10倍连续稀释(1 000,100,10,0 μg/ml)的苦参碱。XTT减低法检测A490。(4) 苦参碱对白念珠菌生物膜作用的形态学观察:将100 μl的菌液(1×106个细胞/ml)接种于96孔板中,分别加入不同浓度(1 000,100,10,0 μg/ml)的苦参碱,37℃培养24 h。倒置显微镜下观察药物对白念珠菌生物膜发育的影响。(5) 细胞毒性实验:方法参照文献[6, 7]。苦参碱与阳性对照两性霉素B自1 000 μg/ml不断两倍稀释直至3.9 μg/ml。溶血百分率计算公式为:溶血百分率=(苦参碱或两性霉素B孔A450-缓冲液孔A450) (Triton X-100孔以A450-缓冲液孔A450) ×100%。
1.3 统计分析应用GraphPad Prism 4.03统计软件进行student's检验。
2 结果 2.1 白念珠菌生物膜的初步鉴定倒置显微镜下酵母细胞与其出芽延伸所形成的菌丝密集交织,并可沿着菌丝形成团块状聚集,呈现多层膜状结构。
2.2 苦参碱对白念珠菌生物膜SMIC随着苦参碱浓度递增,其对白念珠菌生物膜的抑制作用呈增强趋势,SMIC50、SMIC80分别为500,1 000 μg/ml。两性霉素B的SMIC50和SMIC80分别为0.49和1.95 μg/ml。
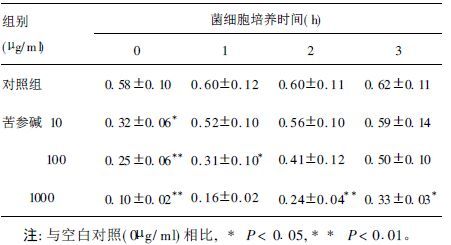
2.3 苦参碱对白念珠菌黏附功能的影响(表 1)培养0,1,2,4 h的白念珠菌细胞经1 000 μg/ml苦参碱作用后测得的A值与空白对照(0 μg/ml)相比,差异均有统计学意义(P<0.05),提示该浓度的苦参碱对菌细胞黏附有抑制作用。培养0,1 h的白念珠菌细胞经100 μg/ml苦参碱作用后以及培养0 h的白念珠菌细胞经10 μg/ml苦参碱作用后测得的A值与空白对照相比,差异均有统计学意义(P<0.05),提示该浓度的苦参碱对菌细胞黏附也有抑制作用,而且随着黏附时间的延长,该抑制作用逐渐减弱。
| 表 1 苦参碱作用不同培养时间的菌细胞A值( x±s) |
2.4 苦参碱对白念珠菌生物膜形态学的影响(图 1)
在倒置显微镜(×200倍)下,1 000 μg/ml的苦参碱作用时,只出现少数的酵母细胞,无菌丝出现;在100 μg/ml苦参碱作用时,可见菌丝以及沿着菌丝分布的酵母细胞;浓度降至10 μg/ml时,可见由更多酵母细胞与菌丝组成的较密集的生物膜。
|
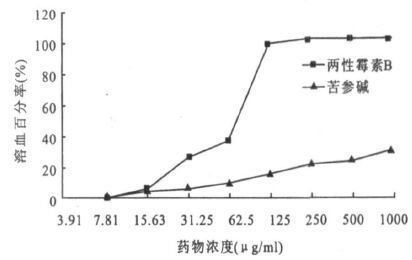
注: 与1% Triton×-100引起的完全溶血相比。 图 1 苦参碱及两性霉素B 引起的溶血吸光度A450 |
3 讨论
苦参碱是中药苦参的有效成分,对多种细菌有较强的抑制作用[8]。最常见的机会感染性真菌白念珠菌容易黏附在生物组织和非生物物体表面形成一种不同于悬浮菌的细胞群体结构-生物膜。生物膜的形成可明显降低其对抗菌药物的敏感性甚至产生耐药,也是构成难治性真菌感染灶中的感染源[9]。
本试验所用菌株为生物膜形成能力较强的标准菌株[5]。结果显示,苦参碱对白念珠菌SMIC50与SMIC80分别为500,1 000 μg/ml,显示出良好的抗生物膜功能。已知在生物膜形成过程中,初始的黏附尤为重要[9]。本实验发现,1 000,100 μg/ml的苦参碱对白念珠菌的早期黏附有明显的抑制功能,表明其对白念珠菌生物膜的发育有明显的干预作用。随着浓度的递增,苦参碱对白念珠菌生物膜的抑制逐渐增强,1 000 μg/ml的苦参碱可完全抑制白念珠菌生物膜的形成。
溶血试验常作为检测抗真菌药物细胞毒性的一个重要指标[5, 7]。本实验中,两性霉B在浓度125 μg/ml时便发生溶血,而苦参碱在1 000 μg/ml时只引起14.05%的溶血。可见,较之于最常用的抗真菌药物之一的两性霉素B,苦参碱具有较弱的细胞毒性。本实验证实,苦参碱具有良好的抗白念珠菌生物膜功能,且毒性较低。因此,对治疗白念珠菌生物膜相关感染性疾病具有应用价值。
| [1] | 黄晓敏, 柯野, 林良佳, 等. 溪黄草复方对金黄色葡萄球菌生物膜影响[J]. 中国公共卫生, 2007, 23(11) : 1350–1352. |
| [2] | 汪长中, 程惠娟, 徐颖, 等. 黄连解毒汤及其单味药对体外白念珠菌生物膜影响的比较[J]. 上海中医药杂志, 2008, 42(2) : 63–65. |
| [3] | Ramage G, Vande Walle K, Wickes BL, et al. St andardized method for in v it ro ant ifungal suscept ibility testing of Candida al bi ca ns biof ilms[J]. Antimicrob Agent s Chemother, 2001, 45(9) : 2475–2479. DOI:10.1128/AAC.45.9.2475-2479.2001 |
| [4] | 孙秋宁, RamageG, Lopez-RibotJL. 念珠菌生物膜体外抗真菌药物敏感性研究[J]. 中华皮肤科杂志, 2002, 35(5) : 409–410. |
| [5] | He M, Du M, Fan M, et al. I n vi tr o activity of eugenol against Candid a al bicans biofilms[J]. Mycopathologia, 2007, 163(3) : 137–143. DOI:10.1007/s11046-007-0097-2 |
| [6] | Ramage G, Wickes BL, L?pez-Ribot JL, et al. Inhibit ion on Candida al bi cans biofilm format ion using divalent cat ion chelat ors(EDTA)[J]. Mycopathologia, 2007, 164(6) : 301–306. DOI:10.1007/s11046-007-9068-x |
| [7] | Wei GX, Bobek LA. In v i tro synergic antifungal ef fect of MUC7 12-mer w ith histatin-512-m et or miconazole[J]. J Antimicrob Chemother, 2004, 53(5) : 750–758. DOI:10.1093/jac/dkh181 |
| [8] | 季宇彬. 中药有效成分药理与应用[M]. 哈尔滨: 黑龙江科学技术出版社, 2004: 60-62. |
| [9] | 李秀丽, 廖万清. 真菌生物膜研究进展[J]. 中国真菌学杂志, 2006, 1(5) : 318–320. |
 2008, Vol. 24
2008, Vol. 24