2. 兰州大学公共卫生学院
迷果芹(Sphallerocarpus gracilis)为伞形科(Umbelliferae)迷果芹属迷果芹的肉质根茎,又名黄参、黄葑、小叶山红罗卜。在我国黑龙江、吉林、甘肃、新疆、青海等地和蒙古及前苏联西伯利亚东部及远东地区均有分布[1, 2]。黄参肉质根茎是一种纯天然保健食品,其中多糖是主要营养成分。目前,植物中多糖含量测定方法主要是硫酸-苯酚法[3-6]。由于受到水解温度、时间、硫酸加入量等因素的影响,采用该方法测定多糖含量时,结果不稳定,误差较大[7-9]。本文应用硫酸-苯酚法建立黄参多糖含量的测定方法,并分别观察温度、时间、浓硫酸加入量对黄参多糖水解的影响,优选其最佳测定条件。现报告如下。
1 材料与方法 1.1 材料T6-紫外可见分光光度计(北京普析通用仪器有限分司);BT-224s型电子天平(德国赛多利斯公司);HH-s水浴锅(巩义市英峪予华仪器厂)。葡萄糖、浓硫酸、苯酚均为AR;黄参(甘肃省山丹县)经兰州大学药学院马志刚教授鉴定为伞形科(Umbelliferae)迷果芹属迷果芹(Sphallerocarpus gracilis)的干燥根。黄参多糖样品由黄参经水提、醇沉、喷雾干燥所得(中国科学院兰州化学物理研究所甘肃省天然药物重点实验室)。
1.2 方法 1.2.1 标准溶液和样品溶液制备(1)标准溶液制备:精密称取105℃干燥至恒重的无水葡萄糖约100 mg,置于100 ml容量瓶内,加水溶解并定容至刻度,即得标准品储备液。精密吸取标准储备液25.0 ml,置于250 ml容量瓶内,加水定容至刻度,即得标准品溶液,备用。(2)样品溶液制备;精密称取黄参多糖样品约50 mg,置于50 ml容量瓶中,超声溶解后,加水定容至刻度。吸取上述溶液5.0 ml,置于50 ml容量瓶中,加水定容至刻度,即得样品溶液。
1.2.2 样品测定分别吸取标准品溶液、样品溶液0.6,2.0 ml,各置于10 ml具塞刻度试管中。标准品溶液试管中加水补充至2.0 ml后,各管中加入5%的苯酚溶液1.0 ml,浓硫酸7.0 ml,充分振摇,静置5 min,置于85℃水浴中加热15 min。取出,冷却至室温。以蒸馏水同法操作制备空白溶液。采用分光光度法,测定样品溶液的吸光度,根据下式计算样品中多糖含量[5]:
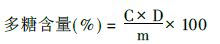
|
式中:C为测得样品溶液中葡萄糖的含量(μg/ml),D为样品溶液的最终稀释体积(ml),m为样品质量(μg)。计算得样品溶液中多糖相当于葡萄糖含量为71.3%,相对标准偏差(RSD)=0.73%(n=3)。
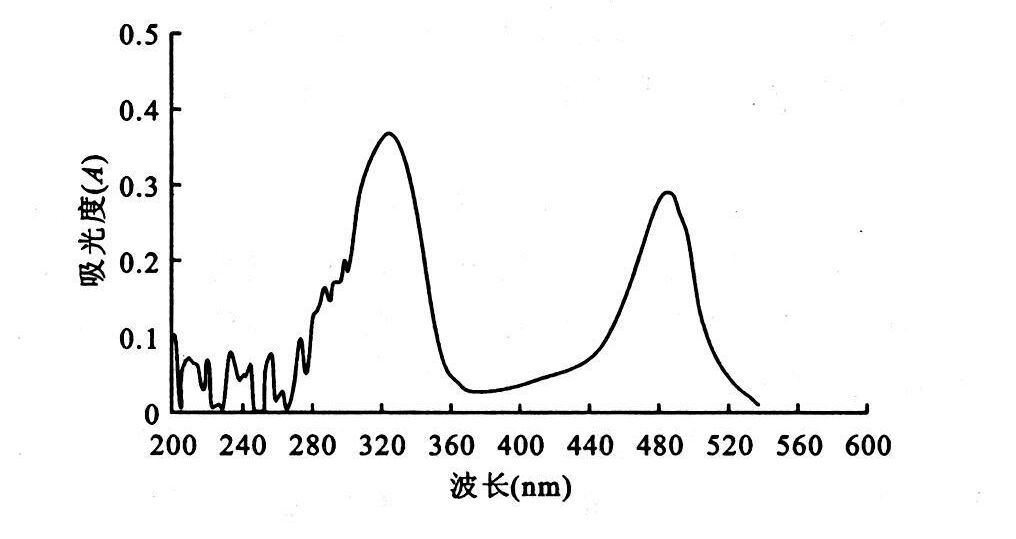
2 结 果 2.1 测定条件的优选 2.1.1 最大吸收波长确定精密吸取标准溶液0.6 ml,按照1.2.2项制备供试液,以蒸馏水同法操作制备空白溶液。在200~600 nm范围内,用紫外分光光度计行全波长扫描,样品溶液在490 nm波长处有最大吸收峰,见图 1。
|
图 1 最大吸收波长选择 |
2.1.2 温度对黄参多糖水解的影响
分别吸取样品溶液各2.0 ml,共7份。各置于10 ml具塞刻度试管中,依次精密加入5%的苯酚溶液1.0 ml,浓硫酸7.0 ml,充分振摇,静置5 min。分别在室温、65℃,70℃,75℃,80℃,85℃,90℃水浴加热30 min后,取出。放至室温,测定吸光度,计算其相应含量。同法测定3次,结果不同温度下其相应平均含量分别为37.3%,38.6%,44.4%,65.3%,66.2%,71.3%,60.9%,表明黄参多糖在85℃时水解最完全。
2.1.3 时间对黄参多糖水解的影响分别吸取样品溶液各2.0 ml,共6份。各置于10 ml具塞刻度试管中,依次精密加放5%的苯酚溶液1.0 ml,浓硫酸7.0 ml,充分振摇,静置5 min,于85℃水浴加热,时间分别设定为15,20,25,30,35,40 min。取出,放至室温,测定吸光度,计算其相应含量。同法测定3次,结果不同时间下其相应平均含量分别为71.25%、71.40%,68.54%,71.40%,70.21%,69.61%,表明黄参多糖在15~40 min范围内水解程度变化不大,相对标准偏差(RSD)为1.66%,故选择水解时间为15 min。
2.1.4 浓硫酸加入量对黄参多糖水解的影响分别吸取样品溶液各2.0 ml,共7份。各置于10 ml具塞刻度试管中,精密加入5%的苯酚溶液1.0 ml,各加入浓硫酸6.0,6.5,7.0,7.5,8.0,8.5,9.0 ml,充分振摇,静置5 min,于85℃水浴加热15 min。取出,放至室温,测定吸光度,计算其相应含量。同法测定3次,结果不同浓硫酸加入量其相应平均含量分别为65.7%,68.9%,71.3%,68.0%,66.2%,63.7%,62.3%,表明浓硫酸加入量在7.0 ml时水解最完全。
2.2 方法学评价 2.2.1 线性方程、相关系数和线性范围分别吸取标准品溶液0.0,0.2,0.6,1.0,1.4,1.8 ml,置于具塞刻度试管中,依次加水补充至最终体积为2.0 ml。各加入5%的苯酚溶液1.0 ml、浓硫酸7.0 ml,充分振摇,静置5 min,85℃水浴加热15 min。取出,冷却至室温。以蒸馏水同法操作制备空白溶液。以多糖浓度C(μg/ml)为横坐标,吸光度A为纵坐标进行线性回归。结果表明,在10.0~90.0 μg/ml浓度范围内,浓度与吸光度呈良好线性关系。回归方程为:A=0.0103C+0.0198,r=0.9991。
2.2.2 稳定性试验将样品溶液每隔30 min测定一次吸光度,连续30 d观察其稳定性。结果在24 h内溶液中多糖含量的RSD为0.5%,表明该法在24 h内基本稳定。
2.2.3 重现性试验制备样品溶液4份。其多糖含量的RSD为0.74%。
2.2.4 加样回收率试验称取黄参多糖样品约50 mg,制备样品溶液。分别精密吸取上述样品溶液0.5 ml共3份,置于10 ml具塞刻度试管中,依次加标淮溶液0.2,0.4,0.6 ml,各加水补至最终体积为2.0 ml。结果平均回收率为98.4%,RSD为1.21%(n=3)。
3 讨 论本文优选最佳条件为:水解温度85℃,水解时间15 min,硫酸加入量7.0 ml。通过方法学评价,表明该法准确、稳定、可靠,可为黄参及其相关产品质量评价和工业化生产提供参考方法。
| [1] | 赵东利, 胡忠, 陈炜, 等. 迷果芹(Sphallerocarpus gracilis)和红三叶(Trifolium pratense)的核型分析[J]. 西北植物学报, 2001, 21(5) : 1026–1027. |
| [2] | 贾恢先, 邹卿, 叶相清. 山丹黄参的分布及微量元系含量研究[J]. 营养学报, 2003, 25(2) : 149–152. |
| [3] | 余晓雷, 张可, 郑旭霞. 芦荟中多糖含量测定方法的探讨[J]. 营养学报, 2003, 25(2) : 149–152. |
| [4] | 朱良, 王一飞, 朱艳梅. 裙带菜孢子叶多糖含量的测定[J]. 食品科学, 2005, 26(10) : 184–186. |
| [5] | 何国良. 灵芝饮品中灵芝肽多糖含量的测定[J]. 营养学报, 1998, 20(1) : 102–104. |
| [6] | 吴拥军, 刘洁, 吴予明, 等. 中药巴戟天多糖的测定及微量元素分析[J]. 光谱学与光谱分析, 2005, 25(12) : 2076–2078. |
| [7] | 张志军, 刘建华, 李淑芳, 等. 灵芝多糖含量的苯酚-硫酸法检测研究[J]. 实用预防医学, 2000, 7(5) : 325–327. |
| [8] | 丁刚强, 于村, 张双凤, 等. 食品多糖含量不同测定方法的研究[J]. 实用预防医学, 2000, 7(5) : 325–327. |
| [9] | Masuko T, Minami A, Iwasaki N, et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format[J]. Anal Biochem, 2005, 339(1) : 69–72. DOI:10.1016/j.ab.2004.12.001 |
 2008, Vol. 24
2008, Vol. 24

