2. 山西省疾病预防控制中心毒理科;
3. 首都医科大学营养与食品卫生教研室
研究发现,细胞凋亡是神经管畸形(neural tube defects,NTDs)发生的重要机制之一[1-4]。细胞凋亡发生过程中有明显的DNA损伤发生。而单细胞凝胶电泳(single cell gel electrophoresis,SCGE)能在单细胞水平上检测DNA链断裂。目前,SCGE被广泛用于生物监测等研究中,而有关其在胚胎神经细胞的DNA损伤中的应用报道较少。本文旨在探讨SCGE在检测神经管畸形胎鼠DNA损伤的应用并完善其在胚胎神经细胞中应用的注意事项,为NTDs的发生和相关干预的机制研究提供实验基础。
1 材料与方法 1.1 试剂环磷酰胺(江苏恒瑞医药股份有限公司);二甲基亚砜(北京化工厂);胰酶、Triton X-100、普通熔点琼脂糖、低熔点琼脂糖及溴化乙啶等试剂(上海生物工程有限公司)。
1.2 实验仪器DY-1电泳仪(北京市六一仪器厂);OLYMPUS荧光显微镜(日本OLYMPUS公司)。
1.3 动物分组、饲养和处理方法健康雌性Wistar大鼠20只,体重250 g左右,未经产,鼠龄2.5~3个月(山西医科大学动物实验中心)。动物室温度20~23℃,湿度50%~55%,自然采光,自由摄食进水。雌雄大鼠适应性喂养3d后按1:1比例合笼,次日晨查阴栓,发现阴栓确定为受孕第0 d,并将孕鼠随机分为对照组和模型组。模型组大鼠于孕13 d时一次性腹腔注射环磷酰胺12.5 mg/(kg.bw),正常对照组于孕13 d,给予0.3 ml的生理盐水。孕14 d时各组随机处死2只孕鼠,采用单细胞凝胶电泳技术检测胎鼠脑组织细胞DNA损伤。其余的孕鼠于孕20 d时处死,剖腹取胎鼠,计算胎鼠NTDs畸形发生率和生长发育指标。
1.4 胚胎脑组织神经细胞DNA损伤检测方法采用单细胞凝胶电泳技术检测胚胎神经细胞的DNA损伤。
1.4.1 神经细胞悬液的制备(1)消化:胎鼠脑组织置于预冷的解剖液中,解剖镜下剥去脑膜,剪碎后,于2 ml 37℃水浴中预热的0.25%的胰酶中准确消化15 min后立即用含有胎牛血清和马血清的DMEM(Dulbecco's modified Eagle's medium)约4~5 ml终止消化。(2)离心、过滤:DMEM液体1 000 r/5min离心洗涤细胞共3次。最后一次洗涤后吸去上清,加入2 ml含血清的DMEM,将细胞吹散后用大于200目的不锈钢网过滤,记数后利用DMEM调整细胞的浓度为1×106。(3)观察细胞的存活状态:取约100 μl的细胞悬液,加少许台盼兰染色,光镜下观察细胞。活细胞透亮而死细胞则被染为蓝色,当观察细胞存活率达99%以上时,可以进行以下步骤。
1.4.2 制备胶片将0.8%的正常熔点琼脂糖100μl滴在磨砂载玻片上,用盖玻片压平胶面,置4℃下固化10 min,然后轻轻移开盖玻片,此为第1层胶;取细胞悬液80 μl在37℃下与低熔点琼脂糖130 μl混匀后迅速铺在第一层胶上,用盖玻片压平胶面,置40℃下固化10 min,再轻轻移开盖玻片,此为第2层胶;然后在第2层胶上再铺上一层0.8%的低熔点琼脂糖70 μl,加上盖玻片,4℃下固化10 min,此为第3层胶。
1.4.3 裂解和解旋移开盖玻片,将制好的胶板水平浸没于新配置的裂解液[NaCl(25 mol/L],乙二胺四乙酸二钠盐(Na2EDTA,100 mmol/L),pH=10,Tris-Cl(10 mmol/L))中。用之前加入1%的Triton X-100和10%的二甲基亚砜(DMSO),4℃下裂解1 h。取出胶板,置于装有电泳缓冲液的水平电泳槽中,静置20 min解旋。
1.4.4 电泳倒入新配置的电泳缓冲液[Na2EDTA(1 mmol/L),pH=13NaOH(300 mmol/L)],电压25V,调整电流为300 mA,4℃下电泳20 min。
1.4.5 中和与染色将胶板取出,水平放入大平皿中,倒入中和液[pH=7.5,Tris-HCl(0.4mol/L)],中和2次,每次15 min。20 μg/ml的溴化乙啶在暗处染色20 min,然后将胶板水平放置在蒸馏水中漂洗15 min,盖上盖玻片。4℃下湿盒中避光保存,尽快阅片。
1.4.6 镜检与计算在荧光显微镜下观察,绿光激发,吸收滤光片590 nm,高速SHD 400摄影和照相,彩色胶卷同步照相。选用彗星细胞发生率(%)和迁移距离估计DNA损伤程度。
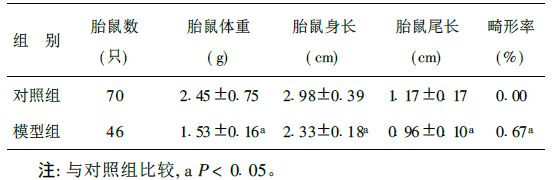
2 结 果 2.1 各组胎鼠生长发育指标和畸形发生率(表 1)表 1可见,模型组胎鼠畸形发生率明显高于正常对照组,且模型组胎鼠的体重、身长和尾长均明显低于对照组。说明在NTDs发生过程中胎鼠的生长发育受到影响。
| 表 1 各组胎鼠的体重、身长、尾长及畸形率(x±s) |
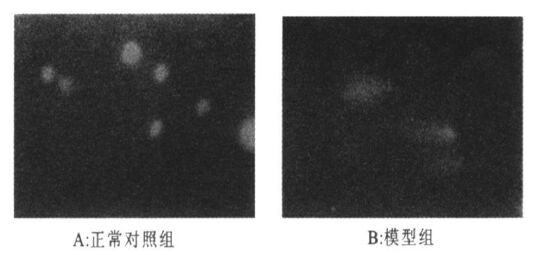
2.2 SCGE检测NTDs胚胎神经细胞的结果(图 1)
正常对照组细胞呈现典型的圆形,而模型组细胞出现明显的拖尾现象即形成/ 彗星0样细胞, 且细胞迁移距离与彗星发生率均显著明显高于对照组。
|
图 1 SCGE法检测正常胎鼠和NTDs 胎鼠神经细胞的结果 |
2.3 各组胎鼠神经细胞彗星发生率及细胞迁移距离
结果可见,模型组细胞迁移距离与彗星发生率均[(16.35±5.59)μm,0.59%],明显高于对照组[(7.28±1.76)μm,0.16%],2组比较,差异有统计意义,P<0.05。
3 讨 论神经管畸形是由于神经管的发生和分化紊乱而导致的发生率高、后果严重的一组出生缺陷。环磷酰胺、是临床上常用的药物,其可引起细胞的凋亡[5]而导致NTDs的发生。细胞凋亡时可见DNA的损伤,本研究利用单细胞凝胶电泳(SCGE)技术,以彗星细胞发生率、DNA迁移距离作为评价指标[6-8],灵敏、直观、简便的检测了CP导致的NTDs发生过程中的DNA损伤变化。结果显示,CP导致NTDs发生时细胞迁移距离与彗星发生率均显著高于对照组,并且NTDs胎鼠的体重、身长及尾长等生长发育指标明显低于对照组。
利用SCGE技术检测胎鼠脑组织神经细胞DNA的损伤时应注意以下事项,以保证结果的灵敏性和特异性:(1)单细胞悬液的浓度调整为1×106;(2)胶板制备时,胶的浓度可以选择在0.5%~1%之间,并要保证胶片表面的平滑;(3)裂解时加入1%的TritonX-100并加细胞保护剂肌氨酸钠或DMSO;(4)电泳时应保持电流、电压的恒定;(5)染色后在2 h内观察荧光效果最好。若不能及时观察可将载玻片盖上盖玻片后放于湿盒中4℃保存,72 h内阅片,防止荧光淬灭。
| [1] | 李玲, 王文青. 酒精致金黄地鼠神经管和眼畸形的实验研究[J]. 解剖学报, 2004, 35(2) : 210–215. |
| [2] | 李勇, 陈星, 赵新荣. 同型半胱氨酸致细胞凋亡与畸胎发生的关系[J]. 卫生研究, 1999, 28(5) : 275–278. |
| [3] | Thayer JM, Mirkes PE. Programmed cell death and n-acetoxy-2-acetylaminofluorene-induced apoptosis in the rat embryo[J]. Tera Jology, 1995, 51 : 418–429. DOI:10.1002/(ISSN)1096-9926 |
| [4] | 肖荣, 赵海峰, 李学敏, 等. 细胞凋亡在环磷酰胺致大鼠神经管畸形中作用[J]. 中国公共卫生, 2003, 7(19) : 824–826. |
| [5] | 孙亦阳,杨兆芬,谢继锋.采用SCGE和SCE分析法研究姬松茸菌体多糖[Ab—Mp]对DNA损伤的抑制作用[J].生物学杂志,2006,23(5):34-37. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_swxzz200605010 |
| [6] | 刘强, 姜恩海, 李进. 单细胞凝胶电泳技术对离体和整体照射致细胞DNA断裂的一致性研究[J]. 中国辐射卫生, 2006, 15(2) : 153–155. |
| [7] | Ejchart A, Sadlej-Sosnowska N. Statistical evaluation and comparison of comet assay results[J]. Mutat Res, 2003, 534(1-20) : 85–92. |
| [8] | Olive PL, Wlode kD, Banáth JE. DNA double-strand breaks measured in individual cell subjected to gel electorophoresis[J]. Cancer Res, 1991, 51(17) : 4671–4677. |
| [9] | Wang X F, Xing M L, Shen Y, et al. Oral administration of Cr(VI) induced oxidative stress,DNA damage and apoptotic cell death in mice[J]. Toxicology, 2006, 228(1) : 16–23. DOI:10.1016/j.tox.2006.08.005 |
| [10] | 李恩民, 杨帆, 陈爱云, 等. 对单细胞凝胶电泳法检测细胞核DNA损伤的影响因素[J]. 汕头大学医学院学报, 2002, 15(1) : 14–16. |
 2008, Vol. 24
2008, Vol. 24