2. 第二军医大学国际合作肿瘤研究所
目前,用于分离细胞的免疫磁珠(IMB)主要以德国Miltenyi公司50nm的免疫磁珠与挪威Dynal公司微米尺寸免疫磁珠为主[1]。其中50nm粒径磁珠分离细胞后无需将磁珠解离就可直接进行下步应用分析,分离纯度高但操作时间长[2];微米粒径磁珠与细胞处于同一尺度量级[3],可在较短时间内完成整个细胞分离过程,但进行下步应用分析时,需将磁珠与细胞分开。本研究以平均粒径为110 nm、高饱和磁化强度(40emu/g)的磁珠作为载体,及其表面联接抗CD11a+模式抗体,获得了可在低梯度磁场下方便而高效分离细胞,且不影响分离后细胞活性的免疫磁珠。现报告如下。
1 材料与方法 1.1 免疫磁珠制备(1)活化:以pH 6.0,0.01 mol/L的NaH2PO4吐温(0.05%Tween-20)溶液作为活化缓冲溶液,取2 mg羧基磁珠于2 ml离心管中,加入500 μl活化缓冲液,在漩涡振荡器上混合均匀,再将离心管放置于磁分离架上,待磁珠完全被吸附,用微型台式真空泵把上清液抽提掉;加入500 μl活化缓冲液重新洗涤磁珠2遍后,向磁珠中加入485 μl活化缓冲液,再分别加入2.5 mg碳二亚胺(EDC,原浓度0.5 g/ml)与N-羟基琥珀酰亚胺(NHS,原浓度0.25 g/ml),在漩涡振荡器上混合均匀,室温活化2 mg磁珠表面的羧基30 min。(2)偶联:以500 μl,pH 7.4,0.01 mol/L的磷酸盐吐温(PBST,0.05%Tween-20)溶液作偶联缓冲液,加500 μl的活化缓冲液重新洗涤已经活化的磁珠3遍后,再用500 μl的偶联缓冲液洗涤磁珠2遍;加475 μl偶联缓冲液重悬洗涤后的磁珠,再加入25 μl 6 mg/ml的抗CD11a+抗体,使得磁珠表面活化的羧基同抗CD11a+抗体的氨基室温反应3 h,将抗体偶联于磁珠表面,得到免疫磁珠。(3)封闭:用500 μl的偶联缓冲液洗涤偶联后磁珠2遍,加入500 μl含有1% 牛血清白蛋白(BSA)的偶联缓冲液封闭磁珠30 min。(4)保存:用500 μl的偶联缓冲液洗涤封闭后的磁珠2遍,用500 μl含0.02% Na3N,0.1%牛血清白蛋白(BSA)的pH 7.4,0.01 mol/L磷酸盐吐温(0.05%Tween-20)溶液重悬磁珠,保存于4 ℃冰箱,待用。
1.2 磁珠粒径分布检测采用HPPS5001型高性能纳米粒度分析仪(英国Malvern公司)测量磁珠的粒度分布,测量条件为:λ=632.8 nm,T=25 ℃。
1.3 抗体偶联量的检测采用(BCA)试剂盒(上海生工生物工程技术服务有限公司)结合酶标仪(美国PerKinEImer公司)检测偶联反应后上清液中抗体的含量。抗CD11a+抗体溶液用pH 7.4,0.01 mol/L磷酸盐吐温(0.05%Tween-20)溶液稀释为0.5 mg/ml的标准溶液,分别取0,1,2,4,8,12,16,20 μl标准液于酶反应条中,每个标准溶液做1个平行重复,每孔加pH 7.4,0.01 mol/L磷酸盐吐温(0.05%Tween-20)溶液补足总体积为20 μl;将待检测上清液12 000 r/min,离心10 min后,取20 μl于酶反应条中,每个待检测上清液做1个平行重复;向所有加了标准液或上清液的酶反应孔中加入200 μl BCA反应液,60 ℃反应30 min;用酶标仪检测各孔的吸光度(A)值。根据标准液的浓度与吸光值做出标准曲线,再根据待检测上清液的吸光度值得到上清液中抗体的量,从而得出单位质量磁珠表面偶联的抗体含量。
1.4 细胞分离将Raji细胞(阴性细胞,1×106/100 μl)与KG-1a细胞(阳性细胞,1×106/100 μl)各100 μl混合于2 ml离心管;(1)加入42 μl免疫磁珠(含抗体量为10 μg),补加158 μl含1%BSA的磷酸盐缓冲液(PBSS);(2)另一离心管中不加磁珠,只加PBSS为阴性对照,最后各管反应体积为400 μl,冰浴反应45 min;分离磁珠,分别收集阴性和阳性细胞,并重悬于200 μl PBSS中,各取100 μl用PBSS洗2遍,重悬于100 μl PBSS中,加入100 μl偶联抗CD11a+抗体的FITC(含抗体量为2 μg)进行标记,冰浴45 min,PBSS洗2遍,用流式细胞仪(美国BD公司,FACS Calibar)检测各管细胞。
1.5 细胞与免疫磁珠结合观察(1)阳性细胞与免疫磁珠、空白磁珠结合状态观察:用TECNAI20S-TWIN 型透射电镜(英国飞利浦公司)观察分离后阳性细胞与磁珠的结合状态;将空白磁珠(未活化,未连接抗体的磁珠)与阳性细胞冰浴反应45 min,用透射电镜(TEM)观察细胞与空白磁珠的结合状态。(2)细胞形态与活性比较:分离后的阳性细胞继续培养在含有10%小牛血清的RPMI-1640培养液(美国海克隆公司)中,置于CO2培养箱(美国热电公司)内培养并维持37 ℃、5%CO2。用光学显微镜在不同时段观察细胞形态与活性,48 h后传代;传代后48 h继续观察细胞。
2 结 果 2.1 磁性微球粒径分布高性能纳米粒度分析仪测量结果显示,磁性微球的平均粒径分布较窄,集中在90~160 nm,平均粒径为110 nm,多分散系数(PDI)为0.076,粒子大小分布比较均匀。
2.2 磁珠表面抗体定量采用BCA蛋白定量试剂盒检测磁珠表面连接的抗CD11a+抗体的量。得到浓度已知的蛋白标准溶液所对应的吸光度值。根据不同标准溶液所含蛋白量与其吸光度值,做标准曲线,得到标准曲线的公式为:y=20.15x-0.198 5(R2=0.998 1)。将上清液样品吸光度值代入公式,得出上清液样品中蛋白含量分别为41.8,48.7 μg,因加入反应抗体为150 μg,即每2 mg磁珠表面连接的抗体量为108.2,101.3 μg;综合以上计算可得,磁珠表面连接的抗CD11a+抗体量平均为52.4 μg/mg。
2.3 细胞分离结果流式分析结果显示,分离前阳性细胞与阴性细胞的比例为47.72:52.33;经过磁分离后,阳性细胞的纯度较高,达到91.71%;上清液中阴性细胞纯度为76.23%,阳性细胞的回收率为64.98%。
2.4 分离后阳性细胞与免疫磁珠、空白磁珠结合状态(图 1)图 1可见,免疫磁珠均匀结合于细胞的表面,并未进入细胞内(图 1a,b,c);与免疫磁珠相比,空白磁珠则较少在细胞的表面均匀粘附,且有部分空白磁珠进入了细胞(图 1d,e)。
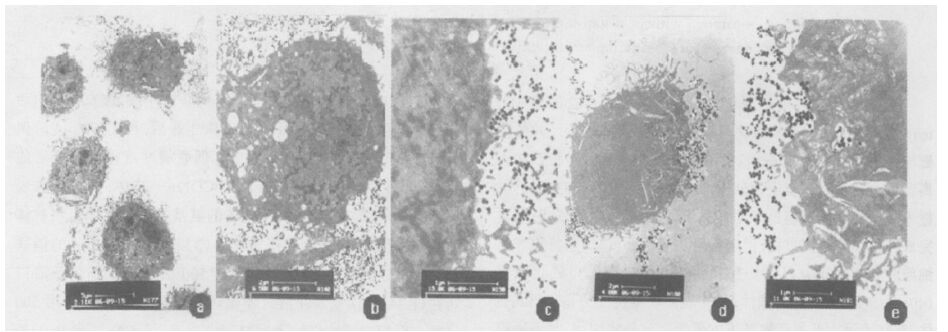
|
注:a:标尺为5 μm;b:标尺为2 μm;c:标尺为1 μm;d:标尺为2 μm;e:标尺为1 μm。 图 1 TEM不同标尺观察免疫磁珠和空白磁珠与阳性细胞的结合状态 |
2.5 细胞的形态与活性(图 2)
图 2可见,分离后细胞的形态跟分离前相同,呈圆形,透亮状;随着培养时间的增加,细胞数量也在不断增多,且细胞状态一直保持良好;对细胞进行传代后,细胞上的磁珠量减少,生长状态仍保持良好,表明免疫磁珠不影响分离细胞的生长活性。

|
注:a:分离前;b:分离后0 h;c:分离后培养12 h;d:分离后培养48 h;e:传代后48 h。 图 2 光镜下磁分离后阳性细胞不同时段继续培养和传代结果 |
3 讨 论
免疫磁珠(IMB)分选细胞技术是近年来发展起来的一项新的细胞分离技术,具有简便易行、分离纯度高、保留细胞活性等优点[4],可用于分离和检测各种骨髓及血细胞、肿瘤细胞、细菌及其他微生物等[5-12]。近几年,免疫磁珠逐步朝着亚微米尺寸方向发展,以使得磁珠能够在低梯度磁场下简便快速分离细胞,又在实施分离后无需将磁珠从细胞表面解离而直接进行后续分析与应用,且磁珠对分离后的细胞活性没有影响。本文结果表明,本实验室制备的磁珠平均水力学粒径为110 nm左右,可简单较高效地分离目标细胞,细胞分选的优化试验正在研究中。
纳米磁珠与细胞的相互作用和磁珠表面的修饰有关[13]。为了研究本实验室制备的免疫磁珠是否影响分选后细胞的活性,将分选后的细胞继续培养。结果表明,本实验室制备的免疫磁珠并不影响细胞活性。这可能是因为免疫磁珠表面偶联的是抗CD11a+抗体,而CD11a是细胞膜上的粘附分子之一,若吞噬细胞缺乏此类分子,会影响其对异物表面的粘附,从而影响细胞吞噬功能的发挥。细胞分离过程中,免疫磁珠表面的抗体跟细胞表面的CD11a特异性结合,减少了细胞表面游离CD11a的数目,从而降低细胞的吞噬作用;而空白磁珠表面无抗CD11a的抗体,不影响细胞表面CD11a的状态,从而不会降低细胞对空白磁珠的吞噬。与目前用于细胞分离的主流磁珠相比,本试验室制备的粒度分布均匀的免疫磁珠具有以下优点:(1)磁珠粒度为亚微米尺度、磁响应性强,不需要专用高梯度磁分离设备[14];(2)分离后不需要酶切等后续步骤将磁珠从目的细胞表面解离,同时免疫磁珠不影响细胞的活性[15]。因此,本实验室的免疫磁珠分别结合了纳米尺度磁珠和微米级别磁珠的优点,通过改变磁珠表面的抗体种类,所制备的免疫磁珠可用于各种细胞分离过程。
| [1] | Chalmers J J, Zborowski M, Moore L, et al. Theoretical analysis of cell separation based on cell surface marker density[J]. Biotechnology and Bioengineerinf, 1998, 59(1) : 10–20. DOI:10.1002/(ISSN)1097-0290 |
| [2] | Thiel A, Scheffold A, Radbruch A. Immunomagnetic cell sorting-pushing the limits[J]. Immunotechnology, 1998, 4 : 89–96. DOI:10.1016/S1380-2933(98)00010-4 |
| [3] | Partington K M, Jenkinson E J, Anderson G, et al. A novel method of cell separation based on dual parameter immunomagnetic cell selection[J]. Journal of Immunological Methods, 1999, 223 : 195–205. DOI:10.1016/S0022-1759(98)00219-1 |
| [4] | Safarik I, Safarikov M. Use of magnetic techniques for the isolation of cells[J]. Journal of Chromatography B Biomed Sci Appl, 1999, 722 : 33–53. DOI:10.1016/S0378-4347(98)00338-7 |
| [5] | Yang H, Qu L, Wimbrow A N, et al. Rapid detection of Listeria monocytogenes by nanoparticle-based immunomagnetic separation and real-time PCR[J]. International Journal of Food Microbiology, 2007, 118 : 132–138. DOI:10.1016/j.ijfoodmicro.2007.06.019 |
| [6] | Hibi K, Mitsubayashi K, Fukuda H, et al. Rapid direct determination using combined separation by prepared immunomagnetic and flow cytometry of Flavobacterium psychrophilum[J]. Biosensors and Bioelectronics, 2007, 22 : 1916–1919. DOI:10.1016/j.bios.2006.08.016 |
| [7] | Chen W, Shen H, Li X, et al. Synthesis of immunomagnetic nanoparticles and their application in the separation and purification of CD34+ hematopoietic stem cells[J]. Applied Surface Science, 2006, 253 : 1762–1769. DOI:10.1016/j.apsusc.2006.03.012 |
| [8] | Barker S D, Casado E, Gomez-Navarro J, et al. An immunomagnetic-based method for the purification of ovarian cancer cells from patient-derived ascites[J]. Gynecologic Oncology, 2001, 82 : 57–63. DOI:10.1006/gyno.2001.6226 |
| [9] | ren A, Huseb C, Iversen A C, et al. A comparative study of immunomagnetic methods used for separation of human natural killer cells from peripheral blood[J]. Journal of Immunological Methods, 2005, 303 : 1–10. DOI:10.1016/j.jim.2005.04.022 |
| [10] | Lara O, Tong X, Zborowski M, et al. Enrichment of rare cancer cells through depletion of normal cells using density and flow-through,immunomagnetic cell separation[J]. Experimental Hematology, 2004, 32 : 891–904. DOI:10.1016/j.exphem.2004.07.007 |
| [11] | 张宏伟, 郑玉梅. 免疫磁珠性质及其应用[J]. 国外医学免疫学分册, 2000, 23(1) : 5–8. |
| [12] | 唐岩, 唐军民, 李银生, 等. 免疫磁珠技术在分离人外周血树突状细胞中的应用[J]. 解剖学杂志, 2003, 26(3) : 298–300. |
| [13] | 鄢祝兵, 马勇杰, 古宏晨, 等. 谷胱甘肽纳米Fe3O4对人肺腺癌细胞SPC-A1影响[J]. 中国公共卫生, 2006, 22(12) : 1445–1447. |
| [14] | Kekarainen T, Mannelin S, Laine J, et al. Optimization of immunomagnetic separation for cord blood-derived hematopoietic stem cells[J]. BMC Cell Biology, 2006, 7(1) : 30. DOI:10.1186/1471-2121-7-30 |
| [15] | Oberg H H, Wesch D, Lenke J, et al. An optimized method for the functional analysis of human regulatory T cells[J]. Immunological Methods, 2006, 64(3) : 353–360. |
 2008, Vol. 24
2008, Vol. 24

 , 古宏晨1, 卢瑛1, 王玲2, 侯盛2
, 古宏晨1, 卢瑛1, 王玲2, 侯盛2