WHO已于2003年将艾滋病、结核、疟疾列为全球三大优先重点防控的感染性疾病。其最有效的防控手段-疫苗的研制仍是世界性难题。其中,疟原虫复杂的生活史和普遍的抗原多态性是疟疾疫苗研究的主要障碍。因此,疟原虫不同种株、不同阶段的特异性保守抗原的成功筛选是疟疾疫苗研制的关键。迄今,有关阻断疟原虫在人群和媒介蚊之间传播的传播阻断疫苗的研究主要集中于蚊阶段表达的特异性蛋白[1, 2]。我国疟疾流行分为混合流行区和单一流行区。配子体是疟原虫由人类传播至媒介昆虫蚊的唯一形式,多种因素对其感染力具有不同程度的影响[3]。P48是配子体表面表达的特异性蛋白。以往研究表明,在不同宿主免疫压力下,疟原虫在其生长/寄生的周期中抗原编码基因存在差异。我们曾分析了我国疟疾中低密度单一流行区湖北、浙江2省的间日疟原虫抗原编码基因Pvs48,仅发现6处错义突变位点,提示其抗原编码基因具有保守性[4-6]。目前,对于我国疟疾混合流行区Pvs48基因特点尚缺乏深入研究。为此,本文分析了我国高发混合流行区间日疟原虫分离株Pvs48的基因特点,并与间日疟原虫标准株Sal-I株比较,检测其突变程度,旨在为间日疟传播阻断疫苗的研究提供实验依据。
1 材料与方法 1.1 样品收集及基因组DNA提取在我国疟疾感染流行季节,从高发混合流行区云南省采集间日疟患者指尖血样本,制备血样滤纸片。应用QIAamp DNA Mini Kit(德国QIAgen Germany)试剂盒,采用文献[7]的方法提取疟原虫基因组DNA。
1.2 目的基因Pvs48的扩增选用Pvs48特异性PCR引物(primer sense:5′-GCT CTA CCG GAA CCA TGT TG-3′; anti-sense: 5′-TTT CCC TAA ATC ATC GCC TG-3′),采用高保真KOD-Plus DNA 聚合酶对目的基因Pvs48进行扩增。扩增体系:10×KOD-Plus缓冲液2μl、dNTPs(2mmol/L)2μl、MgSO4(25mmol/L)1μl、PCR引物(10μmol/L)各1.0μl、KOD-Plus DNA 聚合酶0.2μl、gDNA 0.5μl和ddH2O 12.3μl,总体积20μl。反应条件:94℃ 2min,94℃ 15s,54℃ 15s,68℃ 1min,共45个循环,68℃延伸5min。
1.3 基因测序与比对分析应用TAKARA Agarose Gel DNA Purification Kit Ver.2.0试剂盒对PCR产物进行纯化、回收,基因测序分析。应用BIOEDIT软件,间日疟标准株Sal-I(日本爱媛大学医学部分子寄生虫学教研室惠赠)作为参照,对其碱基序列和推导的氨基酸序列进行比对分析。
2 结果 2.1 PCR扩增片段共成功扩增16例间日疟原虫Pvs48基因,长度1340bp,编码447个氨基酸。
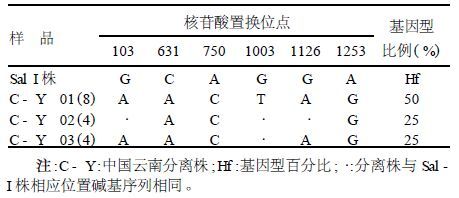
2.2 核苷酸水平与间日疟标准株Sal-I比较,在碱基水平上共发现6处错义突变(G/A103、C/A631、A/C750、G/T1003、G/A1126、A/G1253)。
2.3 基因型(表 1)上述核苷酸替换共产生3种基因型。
| 表 1 Pvs48核苷酸突变位点 |
2.4 氨基酸水平
在氨基酸水平,共发现6处置换(E/K35、H/N211、K/N250、D/Y335、A/T376、K/R418)。其中H/N211、A/T376和K/R418为保守性置换,E/K35和K/N250为半保守性置换,而D/Y335为非保守性置换。
2.5 氨基酸型(表 2)上述氨基酸置换共产生3种氨基酸型。
| 表 2 Pvs48氨基酸置换 |
3 讨论
间日疟的分子生物学和免疫学解析已成为当今疟疾防控迫切需要解决的课题之一。我们前期对我国疟疾中低密度单一流行区间日疟原虫Pvs48进行分析,发现其突变位点有限。
本实验结果表明,在16例分离株中检测到6处核苷酸突变位点,与我们报道的间日疟中低密度单一流行区湖北、浙江省分离株的突变位点完全一致[3],提示无论我国间日疟原虫中低密度单一流行区和高发的混合流行区分离株Pvs48基因均具有高度的保守性。
P48与表达于疟原虫蚊体内发育阶段合子和动合子表面的传播阻断疫苗抗原P25/28相比,更早地出现在感染宿主体内,自然感染可产生加强免疫效果[8]。同时,由于作用靶位不同,以此为基础构建的疫苗与P25/28传播阻断疫苗联合应用将产生叠加的传播阻断效果,为高效疟疾传播阻断复合疫苗的研制带来新的突破。
| [1] | Kongkasuriyachai D, Bartels-Andrews L, Stowers A, et al. Potent immunogenicity of DNA vaccines encoding Plasmodium vivax transmission-blocking vaccine candidates Pvs25 and Pvs28-evaluation of homologous and heterologous antigen-delivery prime-boost strategy[J]. Vaccine, 2004, 22(23-24) : 3205–3213. DOI:10.1016/j.vaccine.2003.11.060 |
| [2] | Contreras Ochoa C, Ramsey JM. Plasmodium vivax and Plasmodium falciparum gametocyte stages are neglected in vaccine development[J]. Salud Publica Mex, 2004, 46(1) : 64–70. DOI:10.1590/S0036-36342004000100009 |
| [3] | 曹雅明, 刘英杰, 张守平, 等. IFN-γ、TNF-α介导约氏疟原虫配子体感染力作用的探讨[J]. 中国公共卫生, 2001, 17(6) : 499–500. |
| [4] | van Dijk MR, Janse CJ, Thompson J, et al. A central role for P48/45 in malaria parasite male gamete fertility[J]. Cell, 2001, 104(1) : 153–164. DOI:10.1016/S0092-8674(01)00199-4 |
| [5] | Bousema JT, Drakeley CJ, Kihonda J, et al. A longitudinal study of immune responses to Plasmodium falciparum sexual stage antigens in Tanzanian adults[J]. Parasite Immunol, 2007, 29 : 309–317. DOI:10.1111/pim.2007.29.issue-6 |
| [6] | 刘军, 冯辉, 郑丽, 等. 我国间日疟原虫传播阻断疫苗候选抗原Pvs48基因特点分析[J]. 中国人兽共患病学报, 2006, 22(1) : 558–560. |
| [7] | Sakihama N, Mitamura T, Kaneko A, et al. Long PCR amplification of plasmodium falciparum DNA extracred from filter paper blots[J]. Exp parasitol, 2001, 97 : 50–54. DOI:10.1006/expr.2000.4591 |
| [8] | Haddad D, Maciel J, Kumar N. Infection with Plasmodium berghei boosts antibody responses primed by a DNA vaccine encoding gametocyte antigen PBs48/45[J]. Infection and Immunity, 2006, 74 : 2043–2051. DOI:10.1128/IAI.74.4.2043-2051.2006 |
 2008, Vol. 24
2008, Vol. 24