2. 吉林大学公共卫生学院卫生部放射生物学重点实验室
研究表明,通过促进肿瘤细胞的凋亡对于肿瘤的治疗具有积极重要的意义。线粒体促凋亡蛋白Smac(the second mitochondria-derived activator of caspase),又称DIABLO(direct IAP-binding protein with low pI),由Du于2000年发现[1, 2]。为探讨Smac基因对肿瘤细胞凋亡的影响及其作用机制,以及探讨以Smac基因为基础的肿瘤基因治疗策略,本实验构建了含人全长型Smac基因的真核表达载体pcDNA3.1+-FL hSmac,并转染肝癌细胞株(SMMC-7721) 。现将结果报告如下。
1 材料与方法 1.1 材料与仪器人宫颈癌细胞株(Hela)、SMMC-7721为本室保存;胎牛血清、1640培养基(美国Gibco公司);pcDNA3.1+真核表达载体、大肠埃希菌工程菌株DH5α为本室保存;lipofectamine 2000(美国Invitrogen公司);Trizol(上海生工公司);RT-PCR试剂盒(杭州博日公司);pMD19T、限制性内切酶、DL2000 Marker(大连宝生物公司);Smac兔多克隆抗体、β-actin兔多克隆抗体(美国Santa Cruz公司);PCR引物合成(大连宝生物公司);其他生化试剂为国产分析纯。TC-1 PCR扩增仪(美国Perkin-Elmer公司);低温高速离心机(日本TOMY公司);分光光度计(美国Beckman公司);紫外凝胶检测和成像系统(美国Bio-Rad公司)。
1.2 方法 1.2.1 细胞培养Hela和SMMC-7721细胞以含10%胎牛血清的1640培养液,于37℃、5% CO2 培养箱中常规培养。
1.2.2 引物的设计合成按Genbank中人Smac的cDNA全长序列(AF262240),利用引物设计软件oligo6.0设计引物。hSmac上游引物(forward primer)F1:5′-gctctagaatggcggctctgaagagttggctgt-3′,含XbaⅠ酶切位点;下游引物(reverse primer)R1:5′-gcggatcctcaatcctcacgcaggt-3′,含BamHⅠ酶切位点。
1.2.3 FL hSmac扩增Hela细胞总RNA提取和RT-PCR分别按Trizol和转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒说明书进行,得到FL hSmac。
1.2.4 pMD19T-FL hsmac载体的构建和鉴定电泳、切胶回收PCR产物,与pMD19T载体16℃连接过夜,转化,筛选阳性克隆进行PCR、酶切以及DNA测序鉴定。
1.2.5 重组真核表达载体pcDNA3.1+-FL hSmac的构建和鉴定测序正确的pMD19T-FL hSmac,BamHⅠ和XbaⅠ双酶切,回收FL hsmac片段;pcDNA3.1+用NheⅠ和BamHⅠ双酶切,回收载体片段。然后二者连接,转化,筛选阳性克隆进行鉴定。
1.2.6 细胞转染转染前1 d用0.25%胰酶消化细胞,以1×105个/孔接种于24孔板,至转染当天细胞达80%~90%。转染步骤按脂质体lipofectamine 2000说明书进行。以空载体转染为阴性对照。另设置转染pcDNA3.1+-EGFP组以通过荧光显微镜和流式细胞术检测转染效率。
1.2.7 目的基因的检测转染48 h后收获细胞,提RNA和蛋白质,采用RT-PCR、Western Blot法检测人Smac基因的表达,分别以β-actin和GAPDH为内参照。RT-PCR引物为:human smac上游:5′-tcagagcctcattccctt-3′,下游:5′-gtgattcctggcggttat-3′,扩增片段大小为372bp;β-actin上游:5′-aaatcgtgcgtgacattaa-3′,下游:5′-ctcgtcatactcctgcttg-3′,扩增片段大小为474 bp。Western Blot操作步骤参照文献[3]。
1.3 统计分析采用SPSS 14.0统计软件进行分析,采用单因素方差分析进行检验。P<0.05表示差异有统计学意义。
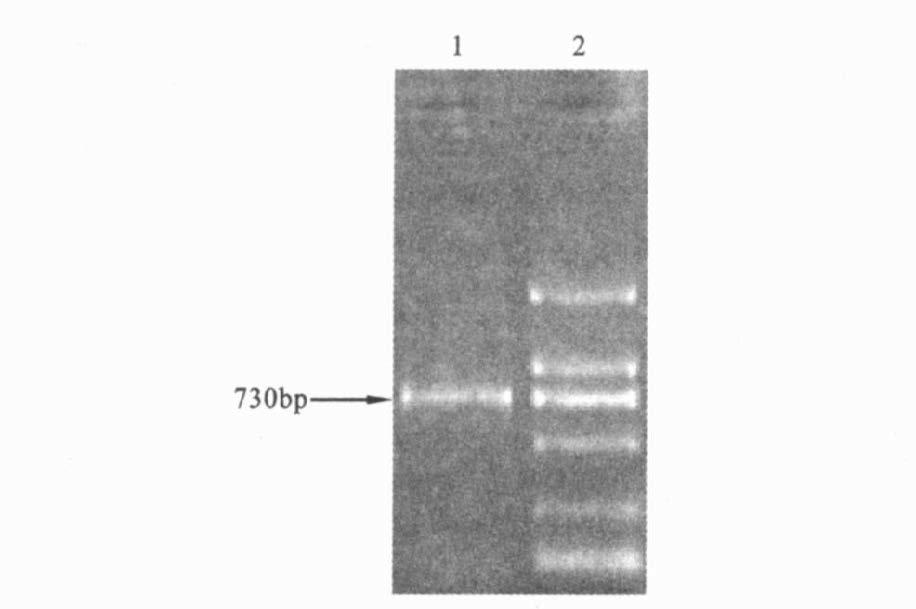
2 结果 2.1 RT-PCR扩增得到目的基因(图 1)FL hsmac基因PCR产物经1.0%琼脂糖凝胶电泳后得到约730 bp的特异性条带,与引物设计时预测大小相一致。
|
注:1 :FL hSmac 基因的PCR 产物;2 :DL2000 Marker 。 图 1 RT- PCR扩增的人Smac 基因 |
2.2 载体pMD19T-FL
hsmac PCR和酶切鉴定(图 2)
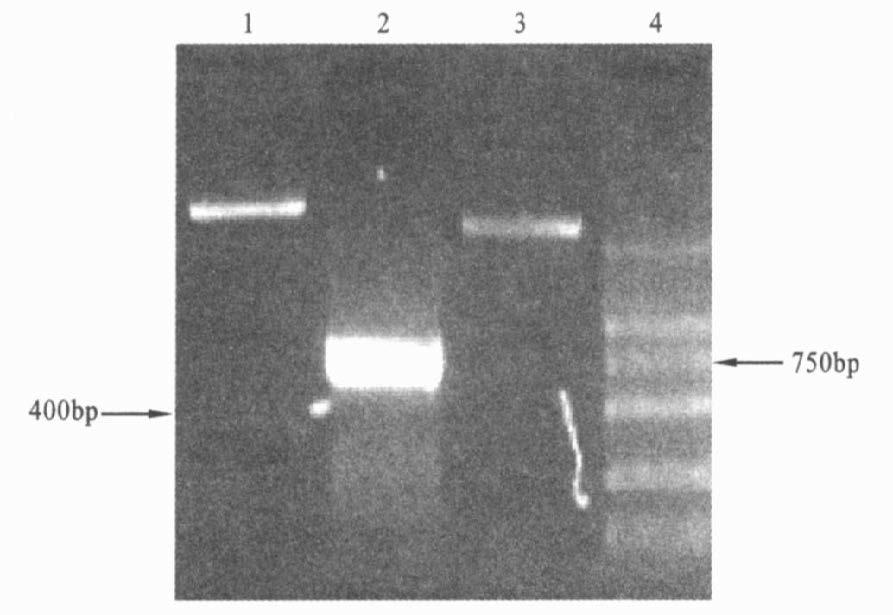
载体pMD19T-FL hsmac长度约为3.4 kb,以该载体为模板,F1和R1为引物进行PCR扩增,产物大小约为730 bp;EcoRⅠ单酶切此载体可得到2个片段,大小分别约为400和3000 bp。
|
注:1 :pMD19T - FL hsmac 质粒EcoR Ⅰ酶切;2 :pMD19T - FL hsmac PCR 产物;3 :pMD19T - FL hsmac 质粒;4 :DL2000 Marker 。 图 2 pMD19T- FL hsmac 载体的PCR、酶切鉴定 |
2.3 载体pMD19T-FL hsmac测序结果
经Blast程序比对序列分析结果证实插入片段与预计插入序列具有100%同源性,即说明本研究已正确克隆了hSmac基因的CDs序列。
2.4 pcDNA3.1+-FL hSmac重组载体的构建及鉴定对重组真核表达载体pcDNA3.1+-FL hSmac分别进行PCR、酶切鉴定。重组载体:长度约为6.1kb,PCR可得到大小约730bp片段。采用SalⅠ单酶切得到大小为2185和3935 bp的2个片段;用ScaⅠ单酶切也得到2个片段,大小为1791和4329 bp;用BglⅡ和BamHⅠ双酶切仍得到2片段,大小分别为1609和4511 bp。酶切所得片段大小均与预计相符,证明重组真核表达载体pcDNA3.1+-FL hSmac构建正确。
2.5 细胞转染条件的优化及转染效率的测定质粒pcDNA3.1+-EGFP与脂质体以不同比例转染SMMC-7721细胞,转染48 h后收获细胞。流式细胞术检测结果表明质粒与脂质体的最适比例为1:2.5,此时细胞转染效率最高,达48%。转染pcDNA3.1+-EGFP的细胞在荧光显微镜下可观察非常明亮的绿色荧光,也说明转染有效。
2.6 Smac基因在SMMC-7721细胞中的表达重组载体pcDNA3.1+-FL hSmac瞬时转染SMMC-7721细胞48 h后,进行RT-PCR,结果发现在372 bp左右发现特异性条带,而且转染pcDNA3.1+-FL hSmac组的Smac表达明显增加。经统计学分析,Smac基因的表达在转染pcDNA3.1+-FL hSmac组与正常对照组、转染空载体组之间差异均有统计学意义(P<0.01),说明转染有效。Western blot检测也显示,转染pcDNA3.1+-FL hSmac组smac蛋白表达明显高于正常对照组、转染空载体组,与RT-PCR结果一致。
3 讨论Smac分为全长型(野生型)和成熟型。在凋亡刺激信号的作用下,野生型Smac蛋白发生裂解,释放成熟的多肽进入胞质中。成熟的Smac蛋白可特异地结合广泛存在于肿瘤细胞中的凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs),解除了IAPs对caspase3、7、9的抑制,从而促进细胞凋亡。Smac还可与其它凋亡调节因子发生作用发挥其促凋亡活性,比如Bcl-2、Bax、P53[4, 5]。Smac可以通过其N-或C-末端促进凋亡、影响细胞周期、增强肿瘤免疫等多方面机制来抵抗肿瘤。研究表明,高表达的Smac可促进肿瘤细胞凋亡,增加肿瘤细胞对放化疗的敏感性[6, 7]。因此,利用Smac基因表达促进肿瘤细胞凋亡正成为抗肿瘤治疗的研究热点。
本实验根据Genbank中人Smac的cDNA全长序列(AF262240)设计引物,不仅使编码Smac的基因片断具有完整的开放读码框架以便表达;而且在引物5′端添加XbaI或BamHI酶切位点和2 个保护碱基以保证酶切反应的顺利进行。载体构建中,利用XbaI和NheI是同尾酶这一特点,成功地将目的基因片段重组到pcDNA3.1+中。结果显示,通过脂质体介导,构建的重组质粒成功地导入SMMC-7721中,Smac mRNA和蛋白表达均增加。这为后续研究Smac基因在肿瘤细胞凋亡过程中的调控作用,以及探讨以Smac基因为基础的肿瘤基因治疗策略提供了基础依据。
| [1] | DU C, Fang M, Li Y, et al. Smac,a mitochondrial protein that promotes cytochrome-dependent caspase activation by elimination IAP inhibition[J]. Cell, 2000, 102(1) : 33–42. DOI:10.1016/S0092-8674(00)00008-8 |
| [2] | Verhagen AM, Ekert PG, Pakusch M, et al. Identification of DIABLO,a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins[J]. Cell, 2000, 102(1) : 43–53. DOI:10.1016/S0092-8674(00)00009-X |
| [3] | 赵鸿梅, 滕秋艳, 张哲, 等. 小鼠Cdc25B融合蛋白构建和表达[J]. 中国公共卫生, 2007, 23(8) : 976–977. |
| [4] | Adrain C, Creagh EM, Martin SJ. Apoptosis-associated release of Smac/DIABLO from mitochondria requires active caspases and is blocked by Bcl-2[J]. Embo J, 2001, 20(23) : 6627–6636. DOI:10.1093/emboj/20.23.6627 |
| [5] | Tsujimoto Y. Cell death regulation by the Bcl-protein family in the mitochondria[J]. J Cell Physiol, 2003, 195(2) : 158–167. DOI:10.1002/(ISSN)1097-4652 |
| [6] | Zheng LD, Xiong ZF, Zhu JW, et al. Effects of Smac gene over-expression on the radiotherapeutic sensitivities of cervical cancer cell line HeLa[J]. Chin Med J(Engl), 2005, 118(3) : 226–230. |
| [7] | Zhao J, Jin J, Zhang X, et al. Transfection of Smac sensitizes tumor cells to etoposide-induced apoptosis and eradicates established human hepatoma in vivo[J]. Cancer Gene Ther, 2006, 13(4) : 420–427. DOI:10.1038/sj.cgt.7700910 |
 2008, Vol. 24
2008, Vol. 24

