2. 中山大学干细胞与组织工程研究中心
近年来,肥胖已成为严重危害人类健康的疾病。肥胖发生核心是脂肪细胞数量增多和体积增大[1]。在脂肪细胞分化过程中,当脂肪细胞过度增生或肥大时,就有蛋白质表达、修饰、种类及表达部位的变化,从而影响细胞功能[2]。因此,本研究以体外诱导人体骨髓间充质干细胞(mesenchymal stem cells,MSCs)分化为脂肪细胞作为模型,采用蛋白组学的方法对成脂分化不同阶段的蛋白表达变化进行比较分析,探讨脂肪形成机制。
1 材料与方法 1.1 材料成人肋骨来源于非血液系统疾病的胸外科手术中摘取的肋骨。
1.2 试剂(1) MSCs的培养和成脂分化所需试剂:高糖和低糖细胞培养液(H-DMEM、L-DMEM)(美国GibcoBRL公司);胎牛血清(FCS)(美国Hyclone公司);地塞米松、3-异丁基-1-甲基黄嘌呤(IBMX)和消炎痛( 美国Sigma公司);牛胰岛素(美国Calbiochem公司)。(2) 蛋白组学分析所需主要试剂:固相pH梯度(IPG)胶条(pH 3~10,24cm)、IPG缓冲液、尿素、两性去污剂(CHAPS)、十二烷基硫酸钠(SDS)、Tris、表面活性剂(TERGITOL NP-7)、丙烯酰胺,甲叉双丙烯酰胺、N',N',N',N'-四甲基乙二胺(TMDEM)、过硫酸铵(APS)、溴酚蓝、甘氨酸、二硫苏糖醇(DTT)和考马斯亮蓝G-250(瑞典Amersham Biosciences公司)。甘油、硫脲、碘乙酰胺(IAA)、三氟醋酸和三丁基磷(TBP)(美国Sigma公司)。乙腈(美国Fisher公司)。测序级胰蛋白酶(美国Promega公司)。
1.3 MSCs的分离和扩增按文献[3]方法进行MSCs的分离和扩增。
1.4 定向诱导MSCs向脂肪细胞分化、鉴定和形态学观察按文献[3]方法,用含有1μmol/L地塞米松、0.5mmol/L IBMX、10μg/ml牛胰岛素和100mmol/L消炎痛的培养液(10% FCS的 H-DMEM),定向诱导MSCs向脂肪细胞分化;油红O染色鉴定脂肪细胞;光镜观察诱导前后细胞形态改变以及脂滴出现的时间,决定动态观察蛋白质表达变化的时间点。
1.5 样本总蛋白质的提取分别将成脂诱导0,1和3周的细胞,用蔗糖缓冲液(10mmol/L Tris,250mmol/L蔗糖,pH 7.0)洗涤3次,加入裂解液(7mol/L尿素,2mol/L硫脲,2% CHAPS,20mmol/L Tris,5mmol/L TBP)裂解细胞。再加入核酸酶缓冲液(RnaseA/DnaseⅠ),室温作用30min,除去核酸。加入丙酮(终浓度80%)沉淀蛋白2h以上。20000g/min离心30min,弃上清;用泡涨缓冲液(7mol/L尿素,2mol/L硫脲,2% CHAPS,0.5% IPG缓冲液,5mmol/L TBP,1% TERGITOL NP-7,0.002%溴酚蓝)重悬沉淀直至蛋白充分溶解。Commassie blue法测定蛋白质浓度,最终使450μl泡涨缓冲液中含800μg蛋白质,-80℃保存。
1.6 双向电泳第一向等电聚焦:800μg总蛋白质加样于Ettan IPGphorⅡ电泳系统(Amersham Biosciences,Sweden)的IPG胶条,等电聚焦自20℃开始:30V,12h;100V,1h;500V,1h;1000V,1h;8000V快速上升总电压达到80000Vh结束。第二向SDS-PAGE:电泳在EttanTM DALTsix垂直电泳系统(Amersham Biosciences,Sweden)中进行。按文献[4]方法配制0.1% SDS、12.5%的聚丙烯酰胺凝胶。电泳条件15℃下,每块胶40mA恒流进行电泳,直至溴酚兰前沿至阳极为0.5cm处停止电泳。考马斯亮兰染色,扫描图像。
1.7 图像分析用ImageMaster 2-D Elite Software 5.0(Amersham Biosciences,Sweden)进行斑点检测、配比、数据库构建和图像分析。计算成脂诱导0,1和3周各组实验所有样本蛋白质斑点的平均吸光度值。以0周为对照,计算各组蛋白质斑点平均吸光度比值(每组实验重复3次以上,n≥3)。以比值>1.5或<0.67(即相差2倍以上)作为蛋白质具有表达差异的阈值,筛选差异蛋白质斑点。
1.8 基质辅助激光解离-飞行时间质谱分析(MALDI-TOF-MS)按文献[5]方法,所有差异蛋白质斑点经胶内酶切后进行MALDI-TOF-MS。基质为50%乙腈及0.1%三氟醋酸。作用模式:反射器,加速电压20kV,质量偏差0.2Da。
1.9 生物信息学分析鉴定所得蛋白质斑点利用MASCOT搜索引擎(http://www.matrixscience.com),检索NCBInr数据库[5]。
2 结果 2.1 光镜下观察MSCs诱导为脂肪细胞的形态变化诱导0周时,细胞形态与成纤维细胞相似,呈梭形(图 1A);诱导1周,细胞核周围有细小脂滴出现(图 1B);诱导2周,细胞核周围可见清晰的脂滴(图 1C),但成脂细胞数量少。诱导3周,细胞体积明显增大,由梭形变为圆形或椭圆形,脂滴聚集成大的脂泡,油红O染色于镜下显橙红色(图 1D)。随机数取10个视野计算结果显示,细胞诱导成脂肪转化率为(80.1±5.2)%。
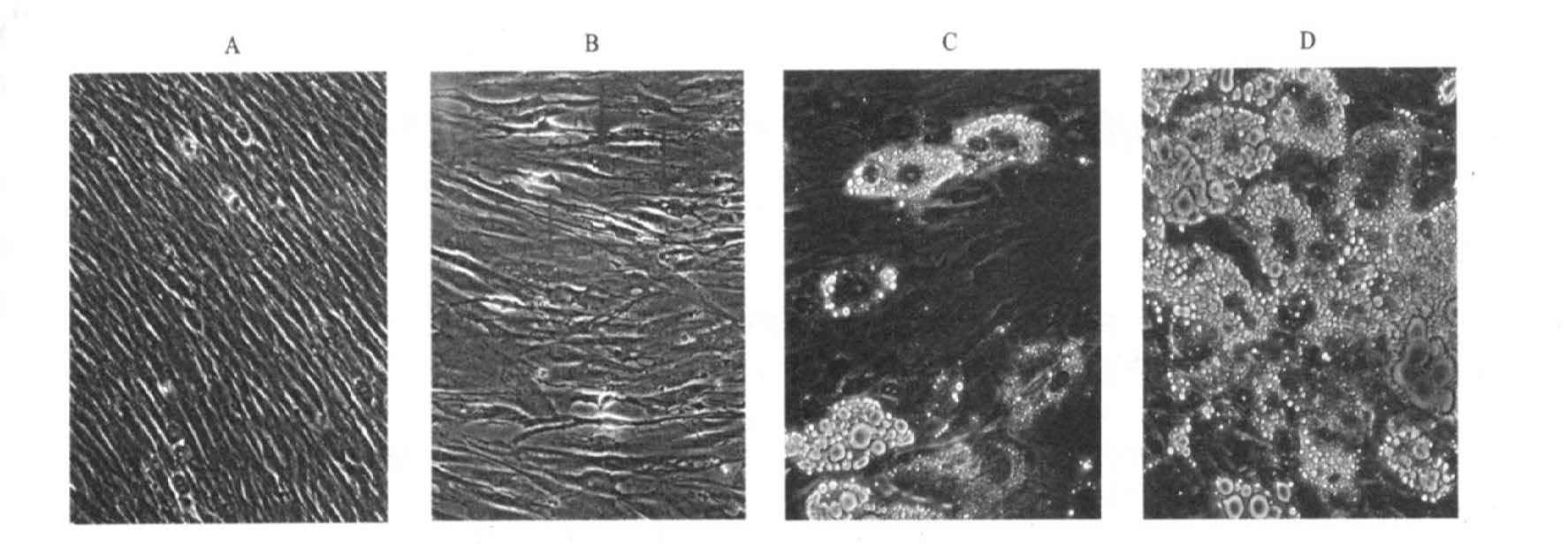
|
注:A:成脂诱导0周; B:成脂诱导1周; C:成脂诱导2周(油红O染色); D:成脂诱导3周(油红O染色)。 图 1 MSCs的成脂分化(×20) |
2.2 成脂分化过程中蛋白质表达的变化
分别收集成脂诱导0,1和3周细胞,提取总蛋白,进行双向电泳、考马斯亮兰染色和图像分析。以0周为对照,比较各组间斑点平均吸光度值的差异,对差异比值>2倍的斑点逐一检查,并确认这些差异斑点(每组实验重复3次以上,n≥3)。将差异蛋白斑点自动化处理、进行质谱和生物信息学分析,最后鉴定出44个表达变化的蛋白。表达变化的蛋白功能性分类表明:(1) 能量代谢激酶占39%,主要包括琥珀酸脱氢酶、泛琨-细胞色素C还原酶、天冬氨酸转氨酶、半乳糖激酶1、异柠檬酸脱氢酶、胆绿素还原酶A、吡咯啉5羧酸还原酶2、羟基丙酮酸还原酶、2,4-dienoyl CoA还原酶、嘌呤核苷磷酸化酶、腺苷酸激酶3、NADH辅酶Q还原酶、丙糖磷酸异构酶、醛酮变位酶Ⅰ、丙酮酸激酶3异构体1和腺苷激酶异构体b等。(2) 具有氧化还原功能的蛋白占6.8%,包括硫氧还蛋白还原酶1、超氧化物歧化酶和硫氧还蛋白。(3) 与蛋白合成或分解有关的蛋白占15.9%,包括葡糖苷酶Ⅱ、延长因子2b、真核翻译起始因子2、真核翻译起始因子3、胞质氨肽酶、泛素乙醛结合物1(ubiquitin aldehyde binding 1)和类泛素接合降解物1(ubiquitin fusion degradation 1-like )。(4) 细胞骨架蛋白占11%,包括钙调结合蛋白1异构体5、层蛋白A/C异构体1、肌动蛋白相关蛋白3、transgelin(平滑肌蛋白)和cofilin 1(调节蛋白) 。(5) 信号蛋白占6.8%,包括Chain A、前B细胞增强因子1和蛋白激酶C。(6) 分子伴侣占4.5%,包括T-complex 1和 SPFH domain family。(7) 其他蛋白(包括钙结合蛋白和离子通道)占4.5%。还有11%假定蛋白功能尚未确定。
3 讨论肥胖是动脉硬化、2型糖尿病、高血压和脂代谢障碍等多种疾病的共同危险因素。肥胖的发生主要是由于脂肪细胞的数目增加和体积增大,而形态显著改变是脂肪细胞分化过程的突出特点,但其中的机制目前尚不完全清楚。研究表明,脂肪细胞来源于脂肪前体细胞,而脂肪前体细胞又是由间充质干细胞分化而来[6]。因此,根据MSCs具有多分化潜能的特性,本实验使用多种激素配方,在体外建立MSCs分化为脂肪细胞的模型,研究脂肪分化过程中蛋白质表达的改变。
实验发现,诱导MSCs成脂肪分化1周,脂质开始累积,镜下可见细胞核周围出现细小脂滴;诱导2周,核周围虽可见清晰脂滴,但成脂细胞数量少。诱导3周,细胞获得成熟脂肪细胞的形态特征,镜下可见成脂细胞体积增大数量增多,脂滴聚成大脂泡,油红O染色显橙红色,表明中性脂质的存在,此阶段细胞已无分裂增殖能力,为脂肪细分化的终末阶段[7]。因此,本实验将诱导MSCs成脂分化0,1和3周作为收集样本的时间点,采用蛋白组学方法,计算3组蛋白质斑点平均吸光度比值,选择差异比值较大的斑点作质谱分析。这样有目的分析表达改变的蛋白,避免了对整个蛋白表达谱分析带来的信息量过大,无从下手的局面。实验结果表明,MSCs分化为脂肪细胞的过程相当复杂。在这个过程中,能量代谢、细胞骨架、氧化还原、蛋白合成与分解、信号传导及分子伴侣等相关蛋白的表达发生了改变,提示这些蛋白在成脂分化过程中起重要作用。实验还发现,多数参与代谢的酶蛋白在成脂分化1周内表达水平发生了改变,这时细胞能量代谢旺盛,增殖活跃,提示MSCs(commitment)向脂肪细胞定向分化和克隆性扩增发生在第1周,这比3T3-F442A细胞的时间长[8],说明MSCs是研究多能前体细胞向包括前脂肪细胞在内的个体细胞系定向分化的有利工具。
| [1] | Prins JB, O’ Rahilly S. Regulation of adipose cell number in man[J]. Clin Sci(Lond), 1997, 92(1) : 3–11. DOI:10.1042/cs0920003 |
| [2] | Van Eyk JE. Proteomics:unraveling the complexity of heart disease and striving to change cardiology[J]. Curr Opin Mol Ther, 2001, 3(6) : 546–553. |
| [3] | 项鹏, 张丽蓉, 陈振光, 等. 成人骨髓间充质干细胞定向诱导为脂肪细胞的研究[J]. 中国病理生理杂志, 2001, 17(7) : 598–601. |
| [4] | Zuo X, Speicher DW. Quantitative evaluation of protein recoveries in two-dimensional electrophoresis with immobilized pH gradients[J]. Electrophoresis, 2000, 21(14) : 3035–3047. DOI:10.1002/(ISSN)1522-2683 |
| [5] | 谢嵘, 朱剑虹, 刘杭, 等. 中枢神经系统血管母细胞瘤的蛋白质组学分析[J]. 中国病神经肿瘤杂志, 2006, 4(3) : 192–199. |
| [6] | Dani C. Embryonic stem cell-derived adipogenesis[J]. Cells Tissues Organs, 1999, 165(3/4) : 173–180. |
| [7] | Ntambi JM, Young-Cheul K. Adipocyte differentiation and gene expression[J]. J Nutr, 2000, 130(12) : 3122S–3126S. |
| [8] | Federico Castro-Munozledo, Alicia Beltra′n-Langarica, Walid Kuri-Harcuch. Commitment of 3T3-F442A cells to adipocyte differentiation takes place during the first 24-36h after adipogenic stimulation:TNF-α inhibits commitment[J]. Experimental Cell Research, 2003, 284(2) : 163–172. |
 2008, Vol. 24
2008, Vol. 24
