2. 中国疾病预防控制中心
军团菌在自然界广泛存在并可导致高病死率,已成为世界性的公共卫生问题,引起普遍关注。而传统的实验室诊断主要依靠细菌培养、生化反应和血清学鉴定.所耗时间比较长,难以适应快速控制疫情的要求。因而,建立-种快速、敏感和准确的实验室检测方法显得尤为必要。TaqMan探针荧光定量PCR方法操作简单、快捷高效、安全。可定量,具有较高的灵敏度和特异性,抗污染性强,现已成功应用到多个领域[1-4]。鉴于mip冶基因表达的产物撕mip蛋白是迄今所公认的嗜肺军团菌的主要毒力因子之一。为嗜肺军团菌所特有[5]。本研究根据嗜肺军团茵的mip基因设计引物和探针,成功建立嗜肺军团菌荧光定量PCR方法。结果报告如下。
1 材料与方法 1.1 材料(1) 菌株:嗜肺军团菌(LP1Pl,LP1P3。LP1P4,LP1P5,LP1P6,U叩,LP1P8,LP1P9,LP1Pl0。LP1Pll,LP1Pl2,LP1Pl3)、博杰曼军团菌、长滩军团菌、杜莫夫军团菌、高尔曼军团菌、米克戴德军团菌、约旦军团菌DNA模板(中国疾病预防控制中心呼吸道室),部分嗜肺军团菌(地方株)、0157:H7大肠埃希菌、伤寒沙门菌、福氏2a志贺菌(本中心菌种室)。(2)培养基:军团菌基础培养基(BCYE)、军团菌选择培养基(GVPC)(广州乐通泰试剂有限公司);普通营养琼脂培养基(杭州天和微生物试剂有限公司)。(3)质粒标准品:将PCR扩增的产物克隆至pMDl8-T载体上,挑取阳性克隆转化至DH5a大肠埃希菌中,增菌后提取质粒DNA进行测序以鉴定插入序列,并测定质粒DNA浓度进行拷贝数的换算。(4)主要试剂与仪器:DNA提取试剂盒、PCR及荧光定量PCR反应试剂(TAKARA宝生物(大连)工程有限公司);Mastercycler梯度PCR仪(德国Eppendorf公司);Mx3000P荧光定量PCR仪(美国Stratagne公司);二氧化碳培养箱(美国Thermo公司);水浴摇床(江苏金坛江南仪器厂SHA—C);浊度仪Densimat bioMerieux、血平板等(法国梅里埃生物公司;军团菌胶乳凝集试剂盒、磁珠等(广州乐通泰试剂有限公司)。(5)引物与探针:针对嗜肺军团菌m咖基因保守序列。设计引物和特异性探针,由TAKARA公司合成,探针5'端标记报告荧光染料6-Carboxyfluorescein(FAM),3'端标记淬灭荧光染料TAMRA。PCR产物长度为147bp。上游引物5'-哪GCAATGTCAACAGC-3';下游引物5'.CCW订AGCCATTGCTTCC-3';探针5'(FAM).CTGCAACCGATGCCACATCATTA(TAMRA).3'。
1.2 方法 1.2.1 菌株培养部分嗜肺军团菌(地方株)划种于GVPC/BCYE平板上培养3 d后,挑取单个菌落制备模板。0157:H7大肠埃希菌、伤寒沙门菌、福氏2a志贺菌均划种于普通营养琼脂平板上培养,挑取单个菌落制备模板。
1.2.2 模板制备采用热裂解法和DNA试剂盒提取法制备DNA模板。热裂解法:挑取单个菌落于装有100μlDNA抽提液的eppendorf管中,放于裂解仪中100℃10min后,12000 r/min离心5 min,取上清,4℃保存备用;DNA试剂盒提取法按操作说明书进行。
1.2.3 嗜肺军团菌的稀释与计数取菌量为5×107 cfu/ml的LP1Pl型军团菌,用双蒸水进行lO倍稀释,从10-3,10-410-5,10-6,100稀释液中吸取100 m到BCYE培养基上,用L棒及时涂布均匀,每个稀释度做3个平皿,于含5%co2的培养箱,37℃,培养3~5 d后进行计数。同时再取每个稀释度的菌液各1ml,制成100μl的模板,用做PCR敏感性试验。
1.2.4 PCR扩增反应(1) 定性PCR扩增体系和反应条件:总反应体系为25μl,包括Taq酶(5U/μl)0.125μl,lO × PCRbuffer(Mg2+free)2.5μl,Mg2++1.5μl。dNTPs 2 μl,上、下游引物各O.5μl,模板2μl,用ddH2O补足至25μl。反应条件为94℃5 min。94℃35 s。55℃35 s,72℃75 s,72℃3 min,35个循环。用2%琼脂糖进行凝胶电泳。(2)荧光定量PCR扩增体系和反应条件:总反应体系为25 m,包括premix EX Taq12.5μl,上游引物0.25μl,下游引物0.25μl,探针0.5μl,模板DNA 2μl,ROX Reference DyeⅡ0.5μl ,用ddH20补足至25μl。反应条件为95℃lO s,1个循环;95℃5 s,60℃20 s,40个循环。(3)引物与探针最佳浓度优化:以相同DNA浓度的LP1Pl菌为PCR反应模板,引物浓度(20μmol/LP1)不变,将引物量从0.15~0.45μl以0.1μl递增;探针浓度(10μlmol/L)不变,探针量从0.3~0.7μl以0.1μl递增;采用矩阵法优选引物和探针的最佳浓度。
1.2.5 荧光定量PCR方法验证(1) 敏感性检验:将上述活菌不同稀释度(嗜肺军团菌LP1Pl型菌株)进行方法敏感性评价同时,另将质粒标准品作lO倍系列稀释.取终浓度为105-lOcopies/反应的质粒DNA 5个样品同样进行方法敏感性检测,并绘制标准曲线。(2)特异性检验:对12株嗜缔军团菌、6株非嗜肺军团菌及3株其他菌株提取DNA,用荧光定量PCR反应系统进行检测,验证方法的特异性。(3)重复性检验:取3个不同DNA浓度样品,对每个浓度样本作3个重复检测。计算Ct值(Ct值含义:每个反应管内荧光信号达到设定的域值时所经历的循环数。)变异系数验证检测体系的稳定性。
1.2.6 PCR阳性结果判定(1) 常规PCR阳性结果判定:电泳条带明显者判定为阳性,不明显者判定为阴性;(2)荧光定量PCR阳性结果判定:荧光定量PCR检测以Ct值<37并且扩增曲线呈S型为阳性判定原则。其中Ct值<35且扩增曲线良好可直接判定为阳性,Ct值35~37之间需要重复实验,2次实验均能得到良好S型扩增曲线方可判定为阳性。
1.2.7 未知样品检测对来自湖州的15份冷却塔水样分别采用传统分离培养法、普通PCR法和荧光定量PCR法进行检测。
2 结果 2.1 引物与探针浓度优化上游引物和下游引物的量分别为O.15,0.25,0.35,0.45仁l;探针量为0.3,0.4,0.5,0.6,0.7μl。模板扩增结果可见,探针量为0.5μl,引物量为0.35出时,Ct值最小,荧光强度增加值(△Rn)较高,探针量为0.6弘l,引物量为0.45μl时,荧光强度增加值(△Rn)最高,Ct值较小。综合考虑,本实验采用引物量为0.35μl,探针量为0.5μl。
2.2 方法特异性利用该法对嗜肺军团菌、非嗜肺军团菌以及其他菌株进行检测。结果表明,本实验体系对嗜肺军团菌表现良好的特异性,而对非嗜肺军团菌、其他菌株及所设置的阴性对照均呈阴性结果。
2.3 方法敏感性(1) 利用活菌进行评价:LPl型菌株不同稀释度平皿培养结果显示,其中10-4~10-7稀释度的平皿菌落数分别为2364,680,52,10 cfu/ml。不同稀释度提取模板经常规PCR检测,其灵敏度为680 cfu/ml,而荧光定量PCR检测灵敏度则为lO cfu/ml。荧光定量PCR检测灵敏度比常规PCR方法高68倍(图 1、图 2)。
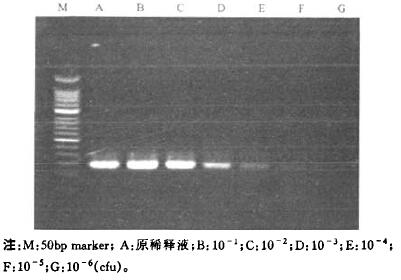
|
图 1 常规PcR检测活菌敏感性结果 |
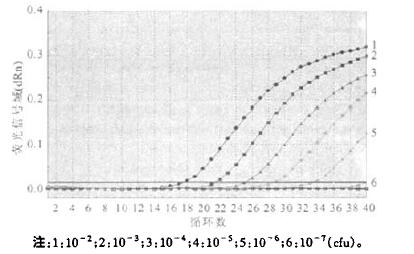
|
图 2 光定量PCR检测活菌敏感性结果 |
(2) 利用质粒标准品进行评价:将构建的质粒载体外标准品稀释成不同浓度,分别用常规PCR与荧光定量PCR进行检测。结果显示,荧光定量方法敏感性达到10 copies/反应,比常规PCR方法灵敏度高100倍左右(图 3,图 4)。以荧光强度的对数值为横坐标,循环数为纵坐标作图,得到1条标准曲线:Y=-3.614×LP1OG(X)+37.93,扩增效率为89.1%,RSq=0.998(图 5)。
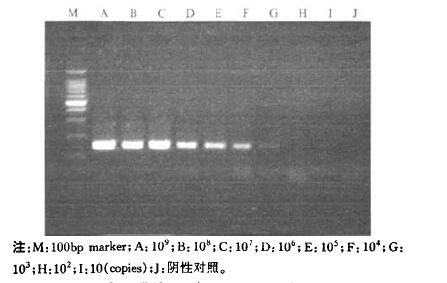
|
图 3 常规PCR检测质粒标准品结果 |
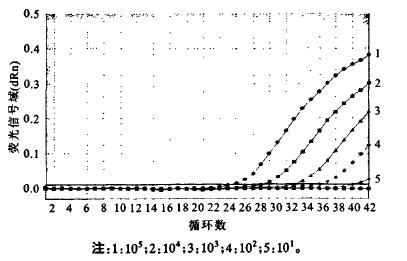
|
图 4 光定量PCR检测质粒结果 |
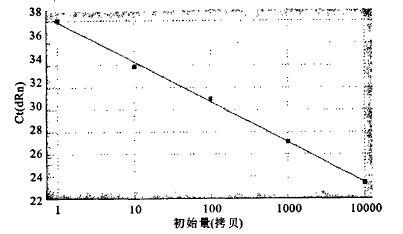
|
图 5 质粒标准曲线 |
2.4 方法重复性评价
对10倍系列稀释的LPl型嗜肺军团菌中的3个不同浓度梯度,每个做3个重复试验,计算各重复样品Ct值之间的变异系数,分别为0.420%,0.385%,0.286%,结果显示。该实验具有较好的重复性(图 6)。2.5未知样品不同方法检测结果用3种方法分别对15份冷却塔水样进行检测。结果显示,所有水样经传统分离培养法和普通PCR法检测均显示为阴性,而荧光定量PCR法检测则显示有3份水样为阳性,该结果经重复测定仍为相同结果。
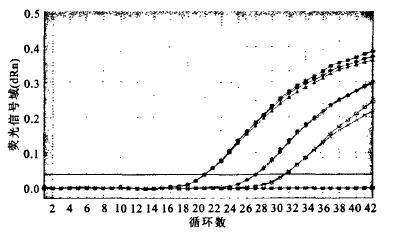
|
图 6 同模板浓度重复性检测结果 |
3 讨论
本研究针对嗜肺军团菌mip基因保守序列设计引物和探针,并进行筛选,得到最佳的引物与探针。利用矩阵配对法对反应体系中的引物、探针浓度进行优化,取得了较为满意的结果。实验表明,该方法特异性强.与对照组菌株未发现有交叉反应;灵敏度高,分别用活菌计数法与质粒外标准品检测本方法灵敏度并与常规PCR法比较,结果本实验得到的灵敏度分别为10cfu/ml和10copies/反应。与Kate[5]报道结果接近,比常规PCR法高68~100倍;稳定性好,每个稀释度做3次重复,Ct值差异极小;实行完全闭管式操作。大大减少扩增产物污染的机会;操作简单,结果判别直观明了,整个过程仅需2h。荧光定量PCR法检测效果好。在15份冷却塔水样检测中,检测出3份水样为阳性.而传统分离培养法及普通PCR法检测均为阴性。本次试验中菌体DNA提取。同时采用热裂解方法和试剂盒提取法,经比较显示,试剂盒提取法优子热裂解方法。试验中还用相同反应体系和反应条件针对不同型号定量扩增仪进行了扩增结果比较,发现不同型号扩增仪其反应条件要求有所不同,故试验时应根据实际情况进行调整。
本方法的建立,不仅可以对医院和其他公共外环境水源的军团菌污染状况进行监测,同时也有利于临床疑似病例的早期快速检测和鉴别诊断,尤其是在对应急样本检测以及军团菌病暴发流行时提供实验室诊断方面。为-种快速、敏感、特异、定量的有效方法。
| [1] | Kaisu Rantakokko-Jalava, Jail Jalava. Development of conventional and real-time PCR assays for detection of Leg/onel/a DNA in respi-ratory speciments[J]. Clinical Microbiology, 2001, 39(8) : 2904–2910. DOI:10.1128/JCM.39.8.2904-2910.2001 |
| [2] | 王小红, 王升启. 荧光定量PCR技术研究进展[J]. 国外医学:分子生物学分册, 2001, 23(1) : 42–45. |
| [3] | 欧阳松应, 杨冬, 欧阳红生, 等. 实时荧光定量PCR技术及其应用[J]. 生命的化学, 2004, 24(1) : 74–76. |
| [4] | 张立国, 张琚. 实时定量PCR技术的介绍[J]. 生物技术, 2003, 13(2) : 39–40. |
| [5] | Kate E Templeton, Sitha A Schaltinga, Peter Silhkens, et al. Sitha A Schaltinga,Peter Silhkens[J]. Clinical microbiologY, 2003, 40(9) : 4016–4021. |
| [6] | Deborah A, Wilson, Belinda Yen-Lieberman. et a1[J]. Clin-ical microbiology, 2003, 41(7) : 3327–3330. DOI:10.1128/JCM.41.7.3327-3330.2003 |
 2008, Vol. 24
2008, Vol. 24
